本试题 “以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+SO2(l)SO32-+SO2+。假若以液态SO2为溶...” 主要考查您对离子化合物
电离方程式
电离平衡常数
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 离子化合物
- 电离方程式
- 电离平衡常数
定义:
含有离子键的化合物称为离子化合物,离子化合物中肯定存在离子键,也可以存在共价键。
含有离子键的化合物称为离子化合物,离子化合物中肯定存在离子键,也可以存在共价键。
定义:
表示电解质电离的式子。强电解质电离用“=”,弱电解质电离用“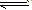 ” 。
” 。
.
表示电解质电离的式子。强电解质电离用“=”,弱电解质电离用“
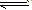 ” 。
” 。.
电离方程式的书写:
1.强电解质的电离用“ ”,弱电解质的电离用 “
”,弱电解质的电离用 “ ”。
”。
2.多元弱酸分步电离,分步持写电离方程式,一般只写第一步;多元弱碱也是分步电离的,但可按一步完全电离写出。例如:
氧硫酸: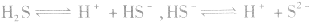
氢氧化铁:
3.强酸的酸式盐完全电离,弱酸的酸式盐中酸式酸根不完全电离。例如: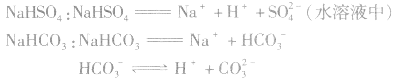
说明:在熔融状态时,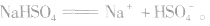
4.某些复盐能完全电离。例如:
电离平衡常数:
1.概念在一定条件下,弱电解质的电离达到平衡时,溶液中电离所生成的各种离子浓度的乘积与溶液中未电离的分子浓度的比是一个常数,这个常数叫做电离平衡常数,简称电离常数。用K表示(酸用 表示,碱用
表示,碱用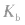 表示)。
表示)。
2.表示方法: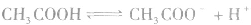
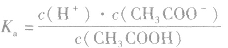
对于多元弱酸,其电离是分步进行的,每步各有电离常数,通常用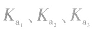 ,等分别表示,且
,等分别表示,且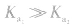
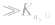
例如: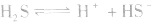
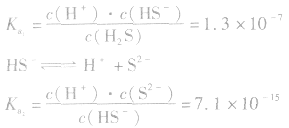
3.影响因素:温度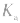 (或
(或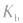 )只随温度变化而变化,不随浓度变化而变化。电离平衡常数,类似于化学平衡常数.
)只随温度变化而变化,不随浓度变化而变化。电离平衡常数,类似于化学平衡常数.
4.意义:反映弱酸,弱碱酸碱性的相对强弱在一定温度下, 越大(多元弱酸以
越大(多元弱酸以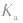 为依据),弱酸的电离程度就越大,浓度相同时c(H+)也越大,弱酸的酸性越强。
为依据),弱酸的电离程度就越大,浓度相同时c(H+)也越大,弱酸的酸性越强。
1.概念在一定条件下,弱电解质的电离达到平衡时,溶液中电离所生成的各种离子浓度的乘积与溶液中未电离的分子浓度的比是一个常数,这个常数叫做电离平衡常数,简称电离常数。用K表示(酸用
 表示,碱用
表示,碱用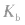 表示)。
表示)。 2.表示方法:
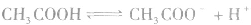
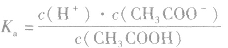
对于多元弱酸,其电离是分步进行的,每步各有电离常数,通常用
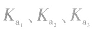 ,等分别表示,且
,等分别表示,且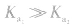
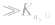
例如:
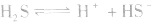
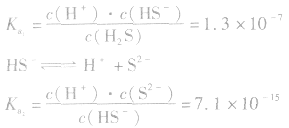
3.影响因素:温度
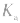 (或
(或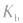 )只随温度变化而变化,不随浓度变化而变化。电离平衡常数,类似于化学平衡常数.
)只随温度变化而变化,不随浓度变化而变化。电离平衡常数,类似于化学平衡常数.4.意义:反映弱酸,弱碱酸碱性的相对强弱在一定温度下,
 越大(多元弱酸以
越大(多元弱酸以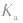 为依据),弱酸的电离程度就越大,浓度相同时c(H+)也越大,弱酸的酸性越强。
为依据),弱酸的电离程度就越大,浓度相同时c(H+)也越大,弱酸的酸性越强。 发现相似题
与“以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O。已知液态SO...”考查相似的试题有:
- 下列物质中属于离子化合物的是( )A.H2B.H2OC.NaOHD.H2S
- A、B、C三种短周期元素,原子序数依次增大,三种元素的原子序数之和为35,A、C同主族,B+核外有10个电子。回答下列问题:(1)A...
- 现有5种短周期元素X、Y、Z、Q、W,原子序数依次增大,在周期表中X原子半径最小;X和W同主族;Y元素原子核外电子总数是其次外...
- 元素X、Y、Z原子序数之和为36,Y、Z在同一周期,X、Z在同一主族,X原子最外层电子数是Y原子最外层电子数的3倍。下列说法不正...
- 现有①NaCl②金刚石 ③NH4Cl ④Na2SO4⑤干冰 ⑥NaOH六种物质,按下列要求回答:(注意(1)(3)两小题用序号填入)(1)属于离子化...
- 下列叙述中错误的是[ ]A.离子键没有方向性和饱和性,而共价键有方向性和饱和性B.两种不同的非金属元素可以形成离子化合物C...
- 下列物质中含有共价键的离子化合物是( )A.Ba(OH)2B.CaCl2C.H2SO4D.NH4Cl
- 现有部分短周期元素的性质或原子结构如下表:(1)写出元素X的离子结构示意图______________。写出元素Z 的气态氢化物的电子式_...
- 下列化学用语表示正确的是[ ]A.硫酸氢钾加热熔融的电离方程式:KHSO4= K++ H++SO42-B.氯化铵溶液显酸性的原因:NH4++H2O =N...
- 下列有关化学用语或名称表达正确的是[ ]A.亚硫酸的电离方程式:H2SO32H++SO32-B.乙炔的分子结构模型示意图:C.H2O2的电子...