本试题 “下表中,对陈述I、Ⅱ的正确性及其有无因果关系的判断不正确的是( )陈述I陈述II判断A干冰升华时,吸收大量的热干冰可做制冷剂I对;II对;有B氢氧化钠固体在空...” 主要考查您对浓硫酸的稀释
金属的物理性质和用途
金属活动性
二氧化碳的用途
离子的共存
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 浓硫酸的稀释
- 金属的物理性质和用途
- 金属活动性
- 二氧化碳的用途
- 离子的共存
浓硫酸:
俗称坏水。坏水指浓度大于或等于70%的硫酸溶液。浓硫酸在浓度高时具有强氧化性,这是它与普通硫酸或普通浓硫酸最大的区别之一。同时它还具有脱水性,强氧化性,难挥发性,酸性,稳定性,吸水性等。
浓硫酸的稀释:
稀释浓硫酸时,一定要将浓硫酸沿着器壁慢慢地注入水里,并不断搅拌,使产生的热量迅速地扩散,切不可把水倒入浓硫酸中,因为水的密度较小,浮在浓硫酸上面,溶解时放出的热会使水立刻沸腾。使硫酸液滴向四周飞溅,这是非常危险的(如下图)。若不慎将浓硫酸沾到皮肤上,应立即用大量水冲洗,然后涂上3%一5%的 NaHCO3溶液。
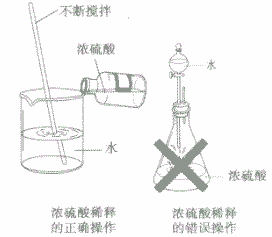
切记“酸入水,沿器壁,慢慢倒,不断搅”。注酸入水不断搅拌
俗称坏水。坏水指浓度大于或等于70%的硫酸溶液。浓硫酸在浓度高时具有强氧化性,这是它与普通硫酸或普通浓硫酸最大的区别之一。同时它还具有脱水性,强氧化性,难挥发性,酸性,稳定性,吸水性等。
浓硫酸的稀释:
稀释浓硫酸时,一定要将浓硫酸沿着器壁慢慢地注入水里,并不断搅拌,使产生的热量迅速地扩散,切不可把水倒入浓硫酸中,因为水的密度较小,浮在浓硫酸上面,溶解时放出的热会使水立刻沸腾。使硫酸液滴向四周飞溅,这是非常危险的(如下图)。若不慎将浓硫酸沾到皮肤上,应立即用大量水冲洗,然后涂上3%一5%的 NaHCO3溶液。

切记“酸入水,沿器壁,慢慢倒,不断搅”。注酸入水不断搅拌
概述:
金属是一种具有光泽(即对可见光强烈反射)、富有延展性、容易导电、导热等性质的物质。金属的上述特质都跟金属晶体内含有自由电子有关。在自然界中,绝大多数金属以化合态存在,少数金属例如金、铂、银、铋以游离态存在。金属矿物多数是氧化物及硫化物。其他存在形式有氯化物、硫酸盐、碳酸盐及硅酸盐。金属之间的连结是金属键,因此随意更换位置都可再重新建立连结,这也是金属伸展性良好的原因。金属元素在化合物中通常只显正价。
金属物理性质的共性:
大多数金属在常温下是固体,具有金属光泽,是电和热的良导体,具有良好的延展性,密度较大,熔沸点较高。
金属物理性质的特性:
不同的金属有其各自的特性。如铁、铝等大多数金属都呈银白色,但铜呈红色,金呈黄色;常温下,铁、铝、铜等大多数金属都是固体,但汞是液体;不同金属的导电性、导热性、密度、熔点、硬度等物理性质差别也较大,见下表。
用途:
钛和钛的合金:可用于制造喷气发动机,轮船外壳,反应器和电信器材。
锌:锌镀在铁的表面,以防止铁被腐蚀;锌还常用于电镀、制造铜合金和干电池。
铜:制造电线、电缆和各种电器。
铝:来冶炼高熔点金属;导电性仅次于银和铜,常用于制造电线和电缆。
物质的性质和用途的关系:
①物质的性质在很大程度上决定了物质的用途,但实际运用时,还需要考虑价格、资源、是否美观、使用是否便利,以及废料是否易于回收和对环境的影响等多种因素。
②应用举例
a.日常生活中菜刀、镰刀、锤子等用铁制而不用铅制,这是因为铁的硬度比铅大,并且铅对人体有害。
b.虽然银的导电性比铜好,但由于银的价格比铜高得多,所以电线一般用铜制而不用银制。
c.灯泡里的灯丝用钨制而不用锡制,这是因为钨是熔点最高的金属,高温时钨丝不易熔化;而锡的熔点最低 (只有232℃),如果用锡制灯丝,只要一开灯,灯丝就会断开,灯泡不能发光。 d.铁制水龙头要镀铬,这是因为镀铬既美观,又耐腐蚀,可延长水龙头的使用寿命。
e.在日常生活中我们还经常用到其他金属,如温度计中的液态金属汞、干电池的锌皮、热水瓶内胆上镀的金属银等。
金属是一种具有光泽(即对可见光强烈反射)、富有延展性、容易导电、导热等性质的物质。金属的上述特质都跟金属晶体内含有自由电子有关。在自然界中,绝大多数金属以化合态存在,少数金属例如金、铂、银、铋以游离态存在。金属矿物多数是氧化物及硫化物。其他存在形式有氯化物、硫酸盐、碳酸盐及硅酸盐。金属之间的连结是金属键,因此随意更换位置都可再重新建立连结,这也是金属伸展性良好的原因。金属元素在化合物中通常只显正价。
金属物理性质的共性:
大多数金属在常温下是固体,具有金属光泽,是电和热的良导体,具有良好的延展性,密度较大,熔沸点较高。
金属物理性质的特性:
不同的金属有其各自的特性。如铁、铝等大多数金属都呈银白色,但铜呈红色,金呈黄色;常温下,铁、铝、铜等大多数金属都是固体,但汞是液体;不同金属的导电性、导热性、密度、熔点、硬度等物理性质差别也较大,见下表。
| 物理性质 | 物理性质比较 |
| 导电性 |  |
| 密度 |  |
| 熔点 |  |
| 硬度 |  |
用途:
钛和钛的合金:可用于制造喷气发动机,轮船外壳,反应器和电信器材。
锌:锌镀在铁的表面,以防止铁被腐蚀;锌还常用于电镀、制造铜合金和干电池。
铜:制造电线、电缆和各种电器。
铝:来冶炼高熔点金属;导电性仅次于银和铜,常用于制造电线和电缆。
物质的性质和用途的关系:
①物质的性质在很大程度上决定了物质的用途,但实际运用时,还需要考虑价格、资源、是否美观、使用是否便利,以及废料是否易于回收和对环境的影响等多种因素。
②应用举例
a.日常生活中菜刀、镰刀、锤子等用铁制而不用铅制,这是因为铁的硬度比铅大,并且铅对人体有害。
b.虽然银的导电性比铜好,但由于银的价格比铜高得多,所以电线一般用铜制而不用银制。
c.灯泡里的灯丝用钨制而不用锡制,这是因为钨是熔点最高的金属,高温时钨丝不易熔化;而锡的熔点最低 (只有232℃),如果用锡制灯丝,只要一开灯,灯丝就会断开,灯泡不能发光。 d.铁制水龙头要镀铬,这是因为镀铬既美观,又耐腐蚀,可延长水龙头的使用寿命。
e.在日常生活中我们还经常用到其他金属,如温度计中的液态金属汞、干电池的锌皮、热水瓶内胆上镀的金属银等。
定义:
金属活动性指金属单质在水溶液中失去电子生成金属阳离子的性质。
常见金属活动性顺序:
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
金属活动性顺序表的意义
(1)金属的位置越靠前,它的活动性越强
(2)位于氢前面的金属能置换出酸中的氢(强氧化酸除外)。
(3)位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来(K,Ca,Na除外)。
(4)很活泼的金属,如K、Ca、Na与盐溶液反应,先与溶液中的水反应生成碱,碱再与盐溶液反应,没有金属单质生成。如:
2Na+CuSO4+2H2O==Cu(OH)2↓+Na2SO4+H2↑
(5)不能用金属活动性顺序去说明非水溶液中的置换反应,如氢气在加热条件下置换氧化铁中的铁:
Fe2O3+3H2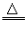 2Fe+3H2O
2Fe+3H2O
金属原子与金属离子得失电子能力的比较

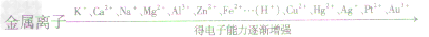
金属活动性顺序表的应用
(1)判断某些置换反应能否发生
a.判断金属与酸能否反应:
条件:
①金属必须排在氢前面
②酸一般指盐酸或稀硫酸
b.判断金属与盐溶液能否反应:
条件:
①单质必须排在盐中金属的前面
②盐必须可溶于水
③金属不包含K、Ca、Na
(2)根据金属与盐溶液的反应判断滤液、滤渣的成分。如向CuSO4,AgNO3混合液中加铁粉,反应后过滤,判断滤液和滤渣成分。铁与CuSO4和AgNO3溶液反应有先后顺序,如果铁足量,先将AgNO3中的Ag完全置换后再置换CuSO4中的Cu,那么溶液中只有FeSO4;如果铁的量不足,应按照“先后原则”分别讨论滤液和滤渣的成分。
(3)根据金属活动性顺序表判断金属与酸反应的速率或根据反应速率判断金属的活动性顺序。如镁、锌、铁三种金属与同浓度的稀H2SO4反应产生氢气的速率:Mg>Zn>Fe,则可判断金属活动性Mg>Zn>Fe,
(4)利用金属活动性顺序表研究金属冶炼的历史。金属活动性越弱,从其矿物中还原出金属单质越容易; 金属活动性越强,从其矿物中还原出金属单质越难。所以越活泼的金属越不易冶炼,难于冶炼的金属开发利用的时间就越迟。
(5)应用举例
a.湿法炼铜我国劳动人民在宋代就掌握了湿法炼铜技术,即将铁放入硫酸铜溶液中置换出铜: Fe+CuSO4=FeSO4+Cu。
b.从洗相废液中回收银洗相废掖中含有大量的硝酸银,可用铁置换回收: Fe+2AgNO3==Fe(NO3)2+2Ag。
c.处理工业废水中的铜、汞离子工业废水中常含铜、汞等金属离子,这些离子对生物有很大的危害,在排放前必须进行处理,可用铁置换回收:Fe+CuSO4==FeSO4+Cu
d.实验室选择金属与酸反应制取氢气在金属活动性顺序表中,H之前的金属都能跟稀 H2SO4、稀HCl反应产生氢气,但Zn之前的金属与酸反应太快。不便操作;Zn之后的金属与酸反应太慢,花费时间太长,从经济效益和反应速率多方而考虑,Zn是最合适的金属。
金属与混合溶液的反应
(1)将一种金属单质放入几种金属的盐溶液的混合液中时,其中排在金属活动性顺序表巾最靠后的金属最先被置换出来,然后再依次置换出稍靠后的金属。简记为“在金属活动性顺序中,距离远,先反应”。如将金属Zn。放入FeSO4和CuSO4的混合溶液中,Zn先与CuSO4发生置换反应,与CuSO4反应完后再与FeSO4 发生置换反应。根据金属锌的最不同可分为以下几种情况:
(2)将几种不同的金属放入同一种盐溶液中,发生反应的情况与将一种金属放入几种金属的盐溶液中相似,也是在金属活动性顺序表中,距离越远的先反应,然后是距离较远的反应。
金属与酸反应生成氢气图像问题的分析方法:
(1)等质氢图:两种金属反应产生的氢气质量相同,此图反映两种情况:

①酸不足,金属过虽,产生的氢气质量由酸的质量决定。
②酸足量,投放的两种金属与酸反应产生氢气的质量恰好相同,如6.5g锌和5.6g铁分别投入足量的盐酸中反应产生的氢气质量相同。
(2)等质等价金属图:如等质量的镁、铁、锌与足量的酸反应生成的金属离子都是+2价,产生氢气的速率和质量不同。此图反映出:

①金属越活泼,图示反应物的线越陡,如Mg线比Zn线陡,Zn线比Fe线陡,说明活泼性Mg>Zn>Fe
②金属的相对原子质量越小。等质量时,与酸反应产生的氢气越多,曲线的拐点越高,因此,相对原子质量Zn >Fe>Mg。
可简单概括为:越陡越活,越高越小。
(3)等质不等价金属图:铝、镁、锌与酸反应生成金属离子的化合价分别为+3、+2、+2,此图反映出等质不等价金属与酸反应不仅速率不同而且生成的氢气的质量与金属化合价有关。
可用下面式子计算氢气质量:

金属与酸或盐溶液反应前后溶液密度变化的判断方法:
金属与酸的反应和金属与盐溶液的反应均为置换反应,反应后溶液的溶质发生了改变,导致溶液的溶质质量分数、溶液的密度也随之改变。反应前后溶液的密度的变化取决于反应前后溶液中溶质的相对分子质量的相对大小。
(1)反应后溶液密度变小:如Fe+CuSO4== FeSO4+Cu,在该反应中,反应前溶液中的溶质为CuSO4,其相对分子质量为160;反应后溶液中的溶质为FeSO4,其相对分子质量为152,由于152<160,故该反应后溶液密度变小。
(2)反应后溶液密度变大:如Zn+H2SO4== ZnSO4+H2↑,在该反应中,反应前溶液中的溶质为H2SO4,相对分子质量为98;反应后溶液中溶质为ZnSO4,相对分子质童为161,由于161>98。故该反应后溶液密度变大。
真假黄金的鉴别:
黄金是一种具有金黄色光泽的金属、化学性质极不活泼。黄铜的外形与黄金非常相似,所以不法分子常用黄铜(Zn,Cu合金)来冒充黄金。但二者之间的性质有很大差异,可用多种方法鉴别。
方法一:取少量金黄色金属块于试管中,加入少量稀盐酸或稀硫酸,若有气泡产生(Zn+2HCl==ZnCl2 +H2),则原试样为黄铜;若没有气泡产生,则原试样为黄金。
方法二:取少量金黄色金属块,用天平称其质量,用量筒和水测出其体积,计算出金属块的密度与黄金的密度对照,若密度相等,则为黄金;若有较大的差异,则为黄铜。
方法三:取少员金黄色金属块在火焰上加热,若金属块表面变黑(2Cu+O2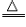 2CuO,则原试样为黄铜;若无变化,则为黄金。
2CuO,则原试样为黄铜;若无变化,则为黄金。
方法四:取少讨金黄色金属块于试管中,向试管中加人适量的硫酸铜溶液,若金属块表而出现红色物质且溶液颜色变浅(Zn+CuSO4==ZnSO4+Cu),则原试样为黄铜;若无变化,则原试样为黄金。
金属活动性指金属单质在水溶液中失去电子生成金属阳离子的性质。
常见金属活动性顺序:
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
金属活动性顺序表的意义
(1)金属的位置越靠前,它的活动性越强
(2)位于氢前面的金属能置换出酸中的氢(强氧化酸除外)。
(3)位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来(K,Ca,Na除外)。
(4)很活泼的金属,如K、Ca、Na与盐溶液反应,先与溶液中的水反应生成碱,碱再与盐溶液反应,没有金属单质生成。如:
2Na+CuSO4+2H2O==Cu(OH)2↓+Na2SO4+H2↑
(5)不能用金属活动性顺序去说明非水溶液中的置换反应,如氢气在加热条件下置换氧化铁中的铁:
Fe2O3+3H2
 2Fe+3H2O
2Fe+3H2O金属原子与金属离子得失电子能力的比较

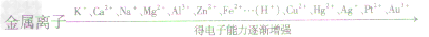
金属活动性顺序表的应用
(1)判断某些置换反应能否发生
a.判断金属与酸能否反应:
条件:
①金属必须排在氢前面
②酸一般指盐酸或稀硫酸
b.判断金属与盐溶液能否反应:
条件:
①单质必须排在盐中金属的前面
②盐必须可溶于水
③金属不包含K、Ca、Na
(2)根据金属与盐溶液的反应判断滤液、滤渣的成分。如向CuSO4,AgNO3混合液中加铁粉,反应后过滤,判断滤液和滤渣成分。铁与CuSO4和AgNO3溶液反应有先后顺序,如果铁足量,先将AgNO3中的Ag完全置换后再置换CuSO4中的Cu,那么溶液中只有FeSO4;如果铁的量不足,应按照“先后原则”分别讨论滤液和滤渣的成分。
(3)根据金属活动性顺序表判断金属与酸反应的速率或根据反应速率判断金属的活动性顺序。如镁、锌、铁三种金属与同浓度的稀H2SO4反应产生氢气的速率:Mg>Zn>Fe,则可判断金属活动性Mg>Zn>Fe,
(4)利用金属活动性顺序表研究金属冶炼的历史。金属活动性越弱,从其矿物中还原出金属单质越容易; 金属活动性越强,从其矿物中还原出金属单质越难。所以越活泼的金属越不易冶炼,难于冶炼的金属开发利用的时间就越迟。
(5)应用举例
a.湿法炼铜我国劳动人民在宋代就掌握了湿法炼铜技术,即将铁放入硫酸铜溶液中置换出铜: Fe+CuSO4=FeSO4+Cu。
b.从洗相废液中回收银洗相废掖中含有大量的硝酸银,可用铁置换回收: Fe+2AgNO3==Fe(NO3)2+2Ag。
c.处理工业废水中的铜、汞离子工业废水中常含铜、汞等金属离子,这些离子对生物有很大的危害,在排放前必须进行处理,可用铁置换回收:Fe+CuSO4==FeSO4+Cu
d.实验室选择金属与酸反应制取氢气在金属活动性顺序表中,H之前的金属都能跟稀 H2SO4、稀HCl反应产生氢气,但Zn之前的金属与酸反应太快。不便操作;Zn之后的金属与酸反应太慢,花费时间太长,从经济效益和反应速率多方而考虑,Zn是最合适的金属。
金属与混合溶液的反应
(1)将一种金属单质放入几种金属的盐溶液的混合液中时,其中排在金属活动性顺序表巾最靠后的金属最先被置换出来,然后再依次置换出稍靠后的金属。简记为“在金属活动性顺序中,距离远,先反应”。如将金属Zn。放入FeSO4和CuSO4的混合溶液中,Zn先与CuSO4发生置换反应,与CuSO4反应完后再与FeSO4 发生置换反应。根据金属锌的最不同可分为以下几种情况:
| 金属锌的量 | 析出金属 | 滤液的成分 |
| 锌不足(不能与CuSO4溶液完全反应) | Cu | ZnSO4、FeSO4、CuSO4 |
| 锌不足(恰好与CuSO4溶液完全反应) | Cu | ZnSO4、FeSO4 |
| 锌不足(不能与FeSO4溶液完全反应) | Fe、Cu | ZnSO4、FeSO4 |
| 锌适量(恰好与FeSO4溶液完全反应) | Fe、Cu | ZnSO4 |
| 锌足量 | Zn、Fe、Cu | ZnSO4 |
金属与酸反应生成氢气图像问题的分析方法:
(1)等质氢图:两种金属反应产生的氢气质量相同,此图反映两种情况:

①酸不足,金属过虽,产生的氢气质量由酸的质量决定。
②酸足量,投放的两种金属与酸反应产生氢气的质量恰好相同,如6.5g锌和5.6g铁分别投入足量的盐酸中反应产生的氢气质量相同。
(2)等质等价金属图:如等质量的镁、铁、锌与足量的酸反应生成的金属离子都是+2价,产生氢气的速率和质量不同。此图反映出:

①金属越活泼,图示反应物的线越陡,如Mg线比Zn线陡,Zn线比Fe线陡,说明活泼性Mg>Zn>Fe
②金属的相对原子质量越小。等质量时,与酸反应产生的氢气越多,曲线的拐点越高,因此,相对原子质量Zn >Fe>Mg。
可简单概括为:越陡越活,越高越小。
(3)等质不等价金属图:铝、镁、锌与酸反应生成金属离子的化合价分别为+3、+2、+2,此图反映出等质不等价金属与酸反应不仅速率不同而且生成的氢气的质量与金属化合价有关。
可用下面式子计算氢气质量:


金属与酸或盐溶液反应前后溶液密度变化的判断方法:
金属与酸的反应和金属与盐溶液的反应均为置换反应,反应后溶液的溶质发生了改变,导致溶液的溶质质量分数、溶液的密度也随之改变。反应前后溶液的密度的变化取决于反应前后溶液中溶质的相对分子质量的相对大小。
(1)反应后溶液密度变小:如Fe+CuSO4== FeSO4+Cu,在该反应中,反应前溶液中的溶质为CuSO4,其相对分子质量为160;反应后溶液中的溶质为FeSO4,其相对分子质量为152,由于152<160,故该反应后溶液密度变小。
(2)反应后溶液密度变大:如Zn+H2SO4== ZnSO4+H2↑,在该反应中,反应前溶液中的溶质为H2SO4,相对分子质量为98;反应后溶液中溶质为ZnSO4,相对分子质童为161,由于161>98。故该反应后溶液密度变大。
真假黄金的鉴别:
黄金是一种具有金黄色光泽的金属、化学性质极不活泼。黄铜的外形与黄金非常相似,所以不法分子常用黄铜(Zn,Cu合金)来冒充黄金。但二者之间的性质有很大差异,可用多种方法鉴别。
方法一:取少量金黄色金属块于试管中,加入少量稀盐酸或稀硫酸,若有气泡产生(Zn+2HCl==ZnCl2 +H2),则原试样为黄铜;若没有气泡产生,则原试样为黄金。
方法二:取少量金黄色金属块,用天平称其质量,用量筒和水测出其体积,计算出金属块的密度与黄金的密度对照,若密度相等,则为黄金;若有较大的差异,则为黄铜。
方法三:取少员金黄色金属块在火焰上加热,若金属块表面变黑(2Cu+O2
 2CuO,则原试样为黄铜;若无变化,则为黄金。
2CuO,则原试样为黄铜;若无变化,则为黄金。方法四:取少讨金黄色金属块于试管中,向试管中加人适量的硫酸铜溶液,若金属块表而出现红色物质且溶液颜色变浅(Zn+CuSO4==ZnSO4+Cu),则原试样为黄铜;若无变化,则原试样为黄金。
二氧化碳用途:
1.二氧化碳不支持燃烧,不能燃烧,比空气重,可用于灭火
2.干冰升华时吸收大量的热,可用它做制冷剂或人工降雨
3.工业制纯碱和尿素,是一种重要的化工原料
4.植物光合作用,绿色植物吸收太阳能,利用二氧化碳和水,合成有机物放出氧气
二氧化碳中毒:
二氧化碳中毒是人吸入高浓度的二氧化碳所出现的昏迷及脑缺氧情况,一般大气中二氧化碳含量超过1%时,人即有轻度中毒反应;当超过3%时,开始出现呼吸困难;超过6%时,就会重度中毒甚至死亡。
(1)征状
中毒主要征状有:头痛、头愫晕、耳鸣、气急、胸闷、乏力、心跳加快,面颊发绀、烦躁、谵妄、呼吸困难,如情况持续,就会出现嗜睡、淡漠、昏迷、反射消失、瞳孔散大、大小便失禁、血压下降甚至死亡。
(2)补救
打开门窗、通风孔,抢救者才可进入。将病人救出后,在空气新鲜处进行人工呼吸,心脏按摩,吸氧(避免高压、高流量、高浓度给氧,以免呼吸中枢更为抑制),开始1~2L/分,随病人呼吸好转逐渐增大给氧量(4--5L/分),以至采用高压氧治疗。(最好是纯氧)
吸入兴奋剂:多种兴奋剂交替、联合使用,如洛贝林、山梗菜碱等。
防止脑和肺水肿:应用脱水剂、激素,限制液量和速度,吸入钠的份量亦应限制。
对症治疗:给予多种维生素、细胞色素C、能量合剂、高渗糖,以防感染。
抢救同时要留意有没有其他有毒气体存在,如一氧化碳等。
1.二氧化碳不支持燃烧,不能燃烧,比空气重,可用于灭火
2.干冰升华时吸收大量的热,可用它做制冷剂或人工降雨
3.工业制纯碱和尿素,是一种重要的化工原料
4.植物光合作用,绿色植物吸收太阳能,利用二氧化碳和水,合成有机物放出氧气
二氧化碳中毒:
二氧化碳中毒是人吸入高浓度的二氧化碳所出现的昏迷及脑缺氧情况,一般大气中二氧化碳含量超过1%时,人即有轻度中毒反应;当超过3%时,开始出现呼吸困难;超过6%时,就会重度中毒甚至死亡。
(1)征状
中毒主要征状有:头痛、头愫晕、耳鸣、气急、胸闷、乏力、心跳加快,面颊发绀、烦躁、谵妄、呼吸困难,如情况持续,就会出现嗜睡、淡漠、昏迷、反射消失、瞳孔散大、大小便失禁、血压下降甚至死亡。
(2)补救
打开门窗、通风孔,抢救者才可进入。将病人救出后,在空气新鲜处进行人工呼吸,心脏按摩,吸氧(避免高压、高流量、高浓度给氧,以免呼吸中枢更为抑制),开始1~2L/分,随病人呼吸好转逐渐增大给氧量(4--5L/分),以至采用高压氧治疗。(最好是纯氧)
吸入兴奋剂:多种兴奋剂交替、联合使用,如洛贝林、山梗菜碱等。
防止脑和肺水肿:应用脱水剂、激素,限制液量和速度,吸入钠的份量亦应限制。
对症治疗:给予多种维生素、细胞色素C、能量合剂、高渗糖,以防感染。
抢救同时要留意有没有其他有毒气体存在,如一氧化碳等。
概念:
所谓离子共存,实质上就是看离子间是否发生反应的问题。若在溶液中发生反应,就不能共存。看能否发生反应,不仅是因为有沉淀、气体、水、难电离的物质产生,还涉及到溶液酸碱性、有色、无色,能否进行氧化还原反应等。
判断离子是否共存的方法:
复分解反应的实质就是两种化合物相互交换成分,生成两种新的化合物,所以同一溶液中的离子之间如符合下列条件之一就会发生反应,即离子不能在溶液中大量共存。
(1)生成沉淀:如Ag+和Cl-,Ba2+和SO42-,Ca2+和 CO32-,Cu2+和OH-等不能大量共存。
(2)生成气体:如H+和CO32-,HCO3-,NH4+和OH-等不能大量共存。
(3)生成水:如H+和OH-不能大量共存。
(4)可能会有附加条件,如溶液无色透明、pH=l (酸性溶液)、pH=14(碱性溶液)等。判断离子能否共存时,应先看清试题的前提条件再分析离子间的相互反应情况。
判断离子是否共存的几种情况:
①由于发生复分解反应,离子不能大量共存。
A.有气体产生。如CO32- 、SO32- 、S2- 、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
B.有沉淀生成。如Ba2+ 、Ca2+ 、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;
Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;
Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
C.一些酸根离子如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;
NH4+与OH-不能大量共存。
②由于发生氧化还原反应,离子不能大量共存。
A.具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
B.在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。
如MnO4-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;
SO32-和S2-在碱性条件下可以共存,
但在酸性条件下则由于发生2S2- +SO32- +6H+=3S +3H2O反应不能共在。
+3H2O反应不能共在。
③溶液中能发生络合反应的离子不能大量共存。
如Fe2+ 、Fe3+与SCN-不能大量共存。
主要题目要求的限定:
①酸性溶液(H+)、碱性溶液(OH-)等不能共存的离子。
②溶液的颜色:有色离子
MnO4-(紫色)、Fe3+(棕黄)、Fe2+(浅绿)、Cu2+(蓝)等
所谓离子共存,实质上就是看离子间是否发生反应的问题。若在溶液中发生反应,就不能共存。看能否发生反应,不仅是因为有沉淀、气体、水、难电离的物质产生,还涉及到溶液酸碱性、有色、无色,能否进行氧化还原反应等。
判断离子是否共存的方法:
复分解反应的实质就是两种化合物相互交换成分,生成两种新的化合物,所以同一溶液中的离子之间如符合下列条件之一就会发生反应,即离子不能在溶液中大量共存。
(1)生成沉淀:如Ag+和Cl-,Ba2+和SO42-,Ca2+和 CO32-,Cu2+和OH-等不能大量共存。
(2)生成气体:如H+和CO32-,HCO3-,NH4+和OH-等不能大量共存。
(3)生成水:如H+和OH-不能大量共存。
(4)可能会有附加条件,如溶液无色透明、pH=l (酸性溶液)、pH=14(碱性溶液)等。判断离子能否共存时,应先看清试题的前提条件再分析离子间的相互反应情况。
判断离子是否共存的几种情况:
①由于发生复分解反应,离子不能大量共存。
A.有气体产生。如CO32- 、SO32- 、S2- 、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
B.有沉淀生成。如Ba2+ 、Ca2+ 、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;
Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;
Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
C.一些酸根离子如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;
NH4+与OH-不能大量共存。
②由于发生氧化还原反应,离子不能大量共存。
A.具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
B.在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。
如MnO4-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;
SO32-和S2-在碱性条件下可以共存,
但在酸性条件下则由于发生2S2- +SO32- +6H+=3S
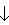 +3H2O反应不能共在。
+3H2O反应不能共在。③溶液中能发生络合反应的离子不能大量共存。
如Fe2+ 、Fe3+与SCN-不能大量共存。
主要题目要求的限定:
①酸性溶液(H+)、碱性溶液(OH-)等不能共存的离子。
②溶液的颜色:有色离子
MnO4-(紫色)、Fe3+(棕黄)、Fe2+(浅绿)、Cu2+(蓝)等
发现相似题
与“下表中,对陈述I、Ⅱ的正确性及其有无因果关系的判断不正确的...”考查相似的试题有:
- 某化学兴趣小组的同学用右图所示的装置进行了一个趣味小实验(图中铁架台等仪器均已略去),在Ⅰ中加入足量固体和过量液体试剂...
- 下列物质属于合金的是A.面粉B.不锈钢C.活性炭D.大理石
- 在Cu(NO3)2、Al(NO3)3和AgNO3的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体上滴加稀硫酸有气泡产生.则滤...
- 如图所示,弹簧秤下挂着一重物A,烧杯中盛有溶液B,试根据要求回答下列问题:(1)若A为铁块,B为稀硫酸,则将A放入B中,过一...
- 为测定铁、铜和银的金属活动性顺序,不能达到目的试剂组是( )A.Ag、Fe、CuSO4溶液B.Ag、FeSO4溶液、CuSO4溶液C.Cu、FeSO...
- 常见金属的化学活动性顺序: K、Ca、_____、_____、______ 、_____、______ 、Sn、Pb、H、______、_______。在金属活动顺序表...
- 下列四种金属中,有一种金属的盐溶液与其他的三种金属都能发生置换反应,这种金属是( )A.铜B.锌C.铁D.镁
- 下列关于金属的说法正确的是A.金属铝比金属锌更耐腐蚀,说明锌比铝活动性强B.铁是地壳中含量最丰富的金属元素C.纯铜的硬度...
- 在Cu(NO3)2、AgNO3和Zn(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤。将滤出的固体充分洗涤后,滴加稀硫酸,有气泡产...
- 在CuCl2和MgCl2的混合溶液中,加入过量锌粉,充分反应后过滤,留在滤纸上的物质是( )A.ZnB.CuC.Cu和MgD.Zn和Cu