本试题 “请用学过的化学知识解释下列生产、生活实际中的一些现象或做法。(1)冬天建筑施工时往砂浆内掺入氯化钙以防冻。 。(2)洗洁精易去除餐具上的油污。 。(3)...” 主要考查您对乳化和乳化作用
灭火的原理和方法
金属的锈蚀与防护
盐的用途
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 乳化和乳化作用
- 灭火的原理和方法
- 金属的锈蚀与防护
- 盐的用途
乳化和乳化作用的概念:
1. 乳化现象:
乳浊液不稳定,静置分层,在乳浊液中加人洗涤剂以后,油虽然并没有溶解在水中,但这时形成的乳浊液却能均匀、稳定地存在而不分层,这种现象叫乳化现象。
“乳化”形成的并不是溶液,例如植物油中加入水,加入乳化剂并不是水溶解了油,只是使植物油分散成无数细小的液滴存在于水中而不聚集。
2. 乳浊液:小液滴分散到液体里形成的混合物。
3. 乳化作用:
乳蚀液的稳定剂是一类表面活性剂,阻止小液滴相互凝结。洗涤剂能把植物油分散成无数细小的液滴而不聚集成大的油珠,洗涤剂所起的作用就是乳化作用,使植物油分散成无数细小的液滴存在于水中而不聚集。
用汽油去油污与用洗涤剂洗去油污的不同:
利用汽油和洗涤剂均能除一去油污,但二者除去油污的原理不同。汽油溶解油污时形成溶液,但加了洗涤剂的水清洗油污是把油污分散成细小的液滴,使其形成乳浊液,再随着水漂走。
除去织物上污渍的方法:
乳化作用在生活中的应用:
①洗涤:用乳化剂(洗涤剂)可以将衣服上、餐具上的油污洗掉,如肥皂、洗洁精等。
②农药的使用:在农药中加入一定量的乳化剂后. 再溶解在有机溶剂里,混合均匀制成的透明液体叫乳油。
1. 乳化现象:
乳浊液不稳定,静置分层,在乳浊液中加人洗涤剂以后,油虽然并没有溶解在水中,但这时形成的乳浊液却能均匀、稳定地存在而不分层,这种现象叫乳化现象。
“乳化”形成的并不是溶液,例如植物油中加入水,加入乳化剂并不是水溶解了油,只是使植物油分散成无数细小的液滴存在于水中而不聚集。
2. 乳浊液:小液滴分散到液体里形成的混合物。
3. 乳化作用:
乳蚀液的稳定剂是一类表面活性剂,阻止小液滴相互凝结。洗涤剂能把植物油分散成无数细小的液滴而不聚集成大的油珠,洗涤剂所起的作用就是乳化作用,使植物油分散成无数细小的液滴存在于水中而不聚集。
用汽油去油污与用洗涤剂洗去油污的不同:
利用汽油和洗涤剂均能除一去油污,但二者除去油污的原理不同。汽油溶解油污时形成溶液,但加了洗涤剂的水清洗油污是把油污分散成细小的液滴,使其形成乳浊液,再随着水漂走。
除去织物上污渍的方法:
| 污渍 | 清洗方法 |
| 蓝墨水 | 白色织物上,可用草酸低稀溶液和漂白剂溶液轮流擦拭,再用洗涤剂和水洗;有色织物上,小心用高锰酸钾溶液擦拭,污渍去掉后,迅速用过氧化氢稀溶液擦拭污渍处,并立即用水漂洗 |
| 圆珠笔油 | 用酒精擦拭,再用洗涤剂洗,最后用水洗 |
| 菜汤,乳汁 | 用酒精擦拭,然后用稀氨水揉搓,再用水洗 |
| 水果渍 | 用氯化钠溶液洗,或用草酸稀溶液沾湿,再用水洗;如果是白色织物,可用过氧化氢稀溶液沾湿,再用水洗 |
| 血渍 | 刚沾上时,立即用冷水洗,再用洗涤剂洗,最后用水洗;沾污时间较长的,可用氨水擦拭,片刻后用冷水洗,如不能除净,用草酸稀溶液洗涤,然后用水洗 |
| 铁锈 | 草酸稀溶液清洗,然后用水洗 |
| 沥青 | 用酒精或汽油擦拭多次,然后用水洗 |
乳化作用在生活中的应用:
①洗涤:用乳化剂(洗涤剂)可以将衣服上、餐具上的油污洗掉,如肥皂、洗洁精等。
②农药的使用:在农药中加入一定量的乳化剂后. 再溶解在有机溶剂里,混合均匀制成的透明液体叫乳油。
灭火的原理:
破坏燃烧的条件,即可达到灭火的目。
①清除可燃物或使可燃物与其他物品隔离;②隔绝氧气(或空气);③使可燃物的温度降到着火点以下。破坏燃烧的三个条件中任何一个即可达到灭火的目的。
灭火原理的实验探究:
灭火方法:
①将可燃物撤离燃烧区.与火源隔离.如液化气、煤气起火,首先要及时关闭阀门,以断绝可燃物的来源;扑灭森林火灾,可用设置隔离带的方法使森林中的树木与可燃烧区隔离
②将燃着的可燃物与空气隔离,如厨房油锅起火,盖上锅盖就能灭火;二氧化碳灭火器能火火的原因之一是灭火器喷出的大量二氧化碳在燃烧物表面形成一层二氧化碳气体层,使燃烧物与在空气隔绝,达到灭火的目的
③用大量的冷却剂(如水、干冰等)冷却可燃物,使温度降低到可燃物的着火点以下,如建筑物起火时,用高压水枪灭火等。
易错点:
灭火时降低温度不是降低着火点,着火点是物质的固有属性,一般情况下不能改变。
几种常见灭火器的灭火原理和适用范围:
泡沫灭火器的灭火原理:
1. 泡沫灭火器的灭火原理:
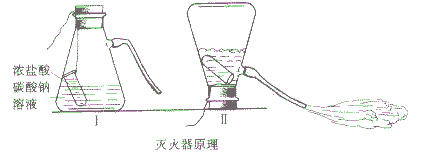
现象:当把吸滤瓶倒置后,浓HCl与Na2CO3溶液剧烈反应,产生大量CO2气体夹带着水从导管喷出。
方程式:Na2CO3+HCl==2NaCl+H2O+CO2↑(泡沫灭火原理)
2. 实际使用的泡沫灭火器,常用硫酸铝来代替盐酸(或硫酸),用碳酸氢钠来代替碳酸钠,为了产生泡沫,常放入甘草或皂角等原来制取液体。把泡沫灭火器倒转时,两种药液相互混合,发生如下反应:Al2(SO4)2+6NaHCO3==3Na2SO4+2Al(OH)3↓+6CO2↑
大量的二氧化碳跟发泡剂形成泡沫,从喷嘴中喷射出来,覆盖在燃烧物上,使燃烧物隔绝空气和降低温度,达到灭火的目的。但是,因为泡沫中含有水分,不宜用于扑救遇水发生燃烧或爆炸的物质(如钾、钠、电石等)引起的火灾;对于电器火灾,要在切断电源后才能使用泡沫灭火器。
破坏燃烧的条件,即可达到灭火的目。
①清除可燃物或使可燃物与其他物品隔离;②隔绝氧气(或空气);③使可燃物的温度降到着火点以下。破坏燃烧的三个条件中任何一个即可达到灭火的目的。
灭火原理的实验探究:
| 实验方案 | 现象 | 分析 |
点燃三支蜡烛,在其中一支蜡烛上扣一只烧杯.将另两支蜡烛放在烧杯中,然后向其中只烧杯中加适量碳酸钠和稀盐酸如下图: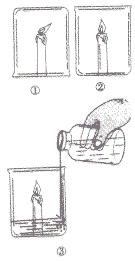 |
①在倒扣烧杯中的蜡烛熄灭 ②正放在烧杯中的蜡烛正常燃烧 ③加入适量碳酸钠和稀盐酸的烧杯中的蜡烛很快熄灭 |
①在倒扣烧杯中的蜡烛因钮气不足而熄灭 ②正放存烧杯中的蜡烛与氧气接触,温度保持在蜡烛的着火点以上,因此能正常燃烧 ⑧稀盐酸与碳酸钠迅速反应产生大量的二氧化碳气体,二氧化碳既不燃烧也不支持燃烧,所以蜡烛很快熄灭。 |
灭火方法:
①将可燃物撤离燃烧区.与火源隔离.如液化气、煤气起火,首先要及时关闭阀门,以断绝可燃物的来源;扑灭森林火灾,可用设置隔离带的方法使森林中的树木与可燃烧区隔离
②将燃着的可燃物与空气隔离,如厨房油锅起火,盖上锅盖就能灭火;二氧化碳灭火器能火火的原因之一是灭火器喷出的大量二氧化碳在燃烧物表面形成一层二氧化碳气体层,使燃烧物与在空气隔绝,达到灭火的目的
③用大量的冷却剂(如水、干冰等)冷却可燃物,使温度降低到可燃物的着火点以下,如建筑物起火时,用高压水枪灭火等。
易错点:
灭火时降低温度不是降低着火点,着火点是物质的固有属性,一般情况下不能改变。
几种常见灭火器的灭火原理和适用范围:
| 灭火器 | 灭火原理 | 适用范围 |
| 泡沫灭火器 | 灭火时.能喷射出大量二氧化碳及泡沫,它们能黏附在可燃物上,使可燃物与空气隔绝,达到灭火的目的 | 可用来扑灭木材、棉布等燃烧引起的灭火 |
| 利用压缩的二氧化碳吹出干粉(主要含有碳酸氧钠)来灭火 | 具有流动性好,喷射率高、不腐蚀容器和不易变质等优良性能,除可用来扑灭一般失火外,还可用来扑灭油、气等燃烧引起的失火 | |
| 在加压时将液态二氧化碳压缩在小钢瓶中,灭火时再将其喷出,有降温和隔绝空气的作用 | 火火时不会因留下任何痕迹而使物体损坏.因此可用来扑灭图书、档案、贵重设备、精密仪器等处的失火.使用时,手一定要先握在钢瓶的木柄上,否则.会把手冻伤。 |
泡沫灭火器的灭火原理:
1. 泡沫灭火器的灭火原理:

现象:当把吸滤瓶倒置后,浓HCl与Na2CO3溶液剧烈反应,产生大量CO2气体夹带着水从导管喷出。
方程式:Na2CO3+HCl==2NaCl+H2O+CO2↑(泡沫灭火原理)
2. 实际使用的泡沫灭火器,常用硫酸铝来代替盐酸(或硫酸),用碳酸氢钠来代替碳酸钠,为了产生泡沫,常放入甘草或皂角等原来制取液体。把泡沫灭火器倒转时,两种药液相互混合,发生如下反应:Al2(SO4)2+6NaHCO3==3Na2SO4+2Al(OH)3↓+6CO2↑
大量的二氧化碳跟发泡剂形成泡沫,从喷嘴中喷射出来,覆盖在燃烧物上,使燃烧物隔绝空气和降低温度,达到灭火的目的。但是,因为泡沫中含有水分,不宜用于扑救遇水发生燃烧或爆炸的物质(如钾、钠、电石等)引起的火灾;对于电器火灾,要在切断电源后才能使用泡沫灭火器。
金属锈蚀:
金属材料受周围介质的作用而损坏,称为金属腐蚀。金属的锈蚀是最常见的腐蚀形态。腐蚀时,在金属的界面上发生了化学或电化学多相反应,使金属转入氧化(离子)状态。这会显著降低金属材料的强度、塑性、韧性等力学性能,破坏金属构件的几何形状,增加零件间的磨损,恶化电学和光学等物理性能,缩短设备的使用寿命,甚至造成火灾、爆炸等灾难性事故。
铁生锈条件的探究
易错点:
①探究铁生锈的条件时采用经煮沸后迅速冷却的蒸馏水,目的是赶走水中溶解的氧气;再加上植物油用来隔绝空气。
②环境中的某些物质会加快铁的锈蚀,如与酸、食盐溶液等接触的铁制品比钢铁生锈更快。
③铁生锈的过程。实际上是铁与空气中的氧气、水蒸气等发生化学反应的过程(缓慢氧化)。反应过程相当复杂,最终生成物铁锈是一种混合物。铁锈(主要成分是Fe2O3·H2O)为红色,疏松多孔,不能阻碍内层的铁继续与氧气、水等反应,因此铁制品可以全部锈蚀。
④许多金属都易生“锈”,但“锈”的结构不同,成分不同。铜在潮湿的空气中也能生“锈”,铜锈即铜绿,其主要成分为碱式碳酸铜[Cu2(OH)2CO3],是铜与水、氧气、二氧化碳共同作用的产物。
金属制品的防锈原理及方法:
(1)防锈原理根据铁的锈蚀条件不难推断出防止铁生锈的方法是使铁制品隔绝空气或隔绝水。
(2)防锈方法:
①保持铁制品表面洁净和干燥,如菜刀不用时擦干放置。
②在钢铁表面覆盖保护膜、如车、船表而涂油漆。
③在钢铁表而镀一层其他金属,如水龙头表面镀铬、镀锌。
④用化学方法使钢铁表面形成致密的保护膜,如烤蓝。
⑤改善金属的结构,如将钢铁制成不锈钢
(3)除锈方法
物理方法:用砂纸打磨,用刀刮。
化学方法:用酸清洗(酸不能过量),发生的反应为:Fe2O3+6HCl==2FeCl3+3H2O或Fe2O3+3H2SO4==Fe2(SO4)3+3H2O。
金属材料受周围介质的作用而损坏,称为金属腐蚀。金属的锈蚀是最常见的腐蚀形态。腐蚀时,在金属的界面上发生了化学或电化学多相反应,使金属转入氧化(离子)状态。这会显著降低金属材料的强度、塑性、韧性等力学性能,破坏金属构件的几何形状,增加零件间的磨损,恶化电学和光学等物理性能,缩短设备的使用寿命,甚至造成火灾、爆炸等灾难性事故。
铁生锈条件的探究
| 实验装置 | 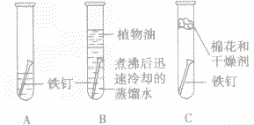 |
| 实验现象 | 几天后观察A试管中铁钉生锈,在水面附近锈蚀 严重,B,C试管中的铁钉没有生锈 |
| 实验分析 | A试管中的铁钉同时跟水、空气(或氧气)接触而生锈; B试管中的铁钉只与水接触不生锈; C 试管中的铁钉只与干燥的空气(或氧气)接触不生锈 |
| 实验结论 | 铁生锈的条件是与水、空气(或氧气)同时接触 |
易错点:
①探究铁生锈的条件时采用经煮沸后迅速冷却的蒸馏水,目的是赶走水中溶解的氧气;再加上植物油用来隔绝空气。
②环境中的某些物质会加快铁的锈蚀,如与酸、食盐溶液等接触的铁制品比钢铁生锈更快。
③铁生锈的过程。实际上是铁与空气中的氧气、水蒸气等发生化学反应的过程(缓慢氧化)。反应过程相当复杂,最终生成物铁锈是一种混合物。铁锈(主要成分是Fe2O3·H2O)为红色,疏松多孔,不能阻碍内层的铁继续与氧气、水等反应,因此铁制品可以全部锈蚀。
④许多金属都易生“锈”,但“锈”的结构不同,成分不同。铜在潮湿的空气中也能生“锈”,铜锈即铜绿,其主要成分为碱式碳酸铜[Cu2(OH)2CO3],是铜与水、氧气、二氧化碳共同作用的产物。
金属制品的防锈原理及方法:
(1)防锈原理根据铁的锈蚀条件不难推断出防止铁生锈的方法是使铁制品隔绝空气或隔绝水。
(2)防锈方法:
①保持铁制品表面洁净和干燥,如菜刀不用时擦干放置。
②在钢铁表面覆盖保护膜、如车、船表而涂油漆。
③在钢铁表而镀一层其他金属,如水龙头表面镀铬、镀锌。
④用化学方法使钢铁表面形成致密的保护膜,如烤蓝。
⑤改善金属的结构,如将钢铁制成不锈钢
(3)除锈方法
物理方法:用砂纸打磨,用刀刮。
化学方法:用酸清洗(酸不能过量),发生的反应为:Fe2O3+6HCl==2FeCl3+3H2O或Fe2O3+3H2SO4==Fe2(SO4)3+3H2O。
常见盐的用途:
1. 氯化钠(NaCl):作调味品和防腐剂,医疗上配置生理盐水。重要的化工原料碳酸钠(Na2CO3):制烧碱,广泛用于玻璃、纺织、造纸等
2. 碳酸氧钠(NaHCO3):工业焙制糕点的发酵粉的主要成分,医疗上治疗胃酸过多
3. 碳酸钙(CaCO3):实验室制取CO2,重要的建筑材料,制补钙剂
4. 硫酸铜(CuSO4): 农业上配制波尔多液,实验室中用作水的检验试剂,精炼铜
5. 高锰酸钾(KMnO4):常作消毒剂
1. 氯化钠(NaCl):作调味品和防腐剂,医疗上配置生理盐水。重要的化工原料碳酸钠(Na2CO3):制烧碱,广泛用于玻璃、纺织、造纸等
2. 碳酸氧钠(NaHCO3):工业焙制糕点的发酵粉的主要成分,医疗上治疗胃酸过多
3. 碳酸钙(CaCO3):实验室制取CO2,重要的建筑材料,制补钙剂
4. 硫酸铜(CuSO4): 农业上配制波尔多液,实验室中用作水的检验试剂,精炼铜
5. 高锰酸钾(KMnO4):常作消毒剂
发现相似题
与“请用学过的化学知识解释下列生产、生活实际中的一些现象或做...”考查相似的试题有:
- 下列说法不正确的是( )A.水是最常见的溶剂B.催化剂一定能加快化学反应的速率C.用灼烧法可以鉴别羊毛和合成纤维D.洗涤剂...
- 化学与生活密切相关,在厨房里蕴藏着许多化学知识。(1)下列食物中,能提供大量维生素的是____(填字母序号,下同)。A.蔬菜B...
- 请根据下列描述回答相关问题:(1)某原子结构示意图为该原子最外电子层上有____个电子,该原子所形成离子的符号是____。(2)糖...
- 下列事故的处理方法错误的是[ ]A.炒菜时油锅着火,立即盖上锅盖B.厨房煤气管道漏气,立即关闭阀门并开窗通气C.档案室资料着火...
- 如图,是铁矿石冶炼、铁生锈、及除锈的主要流程,请按要求回答问题:(1)铁生锈的条件是______(2)写出有关化学反应方程式①...
- 用相应物质的化学式填空.古代山西有许多领先的化学工艺.如1989年永济出土四尊唐代铁牛,每尊重达30吨,震惊中外.现代炼铁...
- 针对下列情况所采取的措施中,错误的是( )A.为防止食品受潮可用生石灰做干燥剂B.重要文件、档案可用碳素墨水书写C.水壶...
- 实验小组的同学研讨初中常见酸、碱、盐之间的反应关系时,做了如下实验,实验中的每一步均有明显现象,实验操作及部分现象如...
- 下列各组物质可按溶解、过滤、蒸发的操作顺序将它们分离的是 ( )A.碳酸钠和碳酸钙B.硝酸钾和硝酸钠C.纯碱和烧碱D.硫酸钠...
- 化学与我们的生活密切相关.现有氦气、氧气、石灰石、活性炭和甲烷五种物质,请用物质(或其主要成分)的化学式进行填空:(1...