本试题 “被霉菌污染的粮食易产生黄曲霉素(C17H12O6).下列说法中错误的是( )A.黄曲霉素是一种有机物B.黄曲霉素中碳元素的质量分数=12×1712×17+l×12+16×6×100%=6...” 主要考查您对有机化合物和无机化合物
物质组成元素的质量比
物质组成元素的质量分数
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 有机化合物和无机化合物
- 物质组成元素的质量比
- 物质组成元素的质量分数
有机化合物:
(1)概念:通常人们将含有碳元素的化合物称为有机化合物,简称有机物,如甲烷、乙醇、葡萄糖、淀粉等。
(2)组成和结构:有机物都含碳元素,多数含有氢元素,可能还含有氧、氮、氯、硫、磷等元素。有机物中碳原子不仅可以和H,O,Cl,,N等原子直接结合,而且碳原子之间也可以互相连接成链状或环状。原子的排列方式不同,形成有机物的结构就不同,所表现出来的性质也不同。
(3)特点:大多数有机化合物都难溶于水,易溶于有机溶剂,大多数有机化合物受热易分解,且容易燃烧,燃烧产物有CO2和水;绝大多数有机化合物不易导电、熔点低。
(4)分类:
①有机物小分子:相对分了质量较小,如乙醇,甲烷、葡萄糖等。
②有机高分子化合物:简称有机高分子,其相对分子质量比较大,从几万到几十万,甚至高达几百万或更高,如淀粉、蛋白质等。
无机化合物:
(1)概念:无机化合物简称无机物,通常指不含碳元素的化合物,但少数含碳元素的化合物,如CO,CO2, H2CO3,CaCO3等,不具有有机化合物的特点,归在无机化合物中。
(2)分类:无机化合物根据元素组成及在水中离解成的粒子特点分为氧化物、酸、碱,盐。
有机化合物与无机化合物的主要区别:
概念的理解:
像NaCl、H2SO4和NaOH等不含碳元素的化合物称为无机化合物,而少数含碳元素的化合物,如CO,CO2和CaCO3等虽然含有碳元素,但具有无机化合物的特点,也把它们看作无机化合物。有机物一定含有碳元素,但含有碳元素的化合物不一定是有机物。含有碳元素但不属于有机物的化合物主要包括: 碳的氧化物、碳酸、碳酸盐和碳酸氢盐。
(1)概念:通常人们将含有碳元素的化合物称为有机化合物,简称有机物,如甲烷、乙醇、葡萄糖、淀粉等。
(2)组成和结构:有机物都含碳元素,多数含有氢元素,可能还含有氧、氮、氯、硫、磷等元素。有机物中碳原子不仅可以和H,O,Cl,,N等原子直接结合,而且碳原子之间也可以互相连接成链状或环状。原子的排列方式不同,形成有机物的结构就不同,所表现出来的性质也不同。
(3)特点:大多数有机化合物都难溶于水,易溶于有机溶剂,大多数有机化合物受热易分解,且容易燃烧,燃烧产物有CO2和水;绝大多数有机化合物不易导电、熔点低。
(4)分类:
①有机物小分子:相对分了质量较小,如乙醇,甲烷、葡萄糖等。
②有机高分子化合物:简称有机高分子,其相对分子质量比较大,从几万到几十万,甚至高达几百万或更高,如淀粉、蛋白质等。
无机化合物:
(1)概念:无机化合物简称无机物,通常指不含碳元素的化合物,但少数含碳元素的化合物,如CO,CO2, H2CO3,CaCO3等,不具有有机化合物的特点,归在无机化合物中。
(2)分类:无机化合物根据元素组成及在水中离解成的粒子特点分为氧化物、酸、碱,盐。
氧化物,酸,碱,盐的比较:
| 物质类别 | 概念 | 分类 |
| 氧化物 | 由两种元素组成,期中一种是氧元素 | 金属氧化物:由金属元素与氧元素组成,如MgO,Fe2O3等 非金属氧化物:由非金属元素与氧元素组成,如CO2、SO2、H2O等 |
| 酸 | 能离解成氢离子和酸根离子的化合物 | 含氧酸:如H2SO4、H2CO3、HNO3等无氧酸:如HCl,H2S等 |
| 碱 | 由金属离子和氢氧根离子构成的化合物 | 可溶性碱:如NaOH,Ca(OH)2等不溶性碱:如Mg(OH)2、 Fe(OH)3等 |
| 盐 | 由金属离子(或铵根离子)和酸根离子构成的化合物 | 正盐:如NaCl、NH4Cl、Na2CO3,仅由金属离子或钱根离子和酸根离子两部分组成酸式盐:如NaHCO3、NH4HCO3,由金属离子或铵根离子、酸式酸根离子构成碱式盐;如Cu2(OH)2CO3,由金属离子、酸根离子和氢氧根离子构成 |
有机化合物与无机化合物的主要区别:
| 有机化合物 | 无机化合物 | |
| 溶解性 | 多数不溶于水。易溶于有机溶剂 | 有些溶于水而不溶于有机溶剂 |
| 耐热性 | 多数不耐热。熔点较低,一般在400℃ 以下 | 多数耐热,难熔化,熔点一般比较高 |
| 可燃性 | 多数可以燃烧 | 多数不能燃烧 |
概念的理解:
像NaCl、H2SO4和NaOH等不含碳元素的化合物称为无机化合物,而少数含碳元素的化合物,如CO,CO2和CaCO3等虽然含有碳元素,但具有无机化合物的特点,也把它们看作无机化合物。有机物一定含有碳元素,但含有碳元素的化合物不一定是有机物。含有碳元素但不属于有机物的化合物主要包括: 碳的氧化物、碳酸、碳酸盐和碳酸氢盐。
定义:
化合物里各元素的质量比是原子个数与相对原子质量的乘积之比。即各元素原子的相对原子质量总和之比。计算的关键在于正确判断出各元素的原子总数。
公式:
各元素的质量比=各元素相对原子质量与相应原子个数的乘积之比。如化学式为AmBn的物质中,A、B两元素的质量比 =(A的相对原子质量×m):(B的相对原子质量×n)。
对概念公式的理解:
(1)元素是宏观概念,只讲种类,不讲个数。用元素符号表示时,7C素符号前后都不能写数字,如计算四氧化三铁(Fe3O4)中铁元素和氧元素的质量比时不能写成3Fe:4O
(2)在化学式中,原子个数比等于元素的质量除以其相对原子质量之比。如AmBn中A,B两元素的质量比为M:N,则化学式中A,B两元素的原子个数比m:n=
(3)当化学式中含有多种元素时,根据化学式可以计算出全部元素的质量比,也可以计算出其中某几种元素的质量比。
化学式中元素质量比的变式运算:
在AmBn中元素A,B的质量比等于各元素的相对原子质m与原子个数的乘积比,即A,B元素质量比= (A的相对原子质量×m):(B的相对原子质量×n),根据元素质量比的变形运算主要有:
(1)根据某化合物中元素的质最比求化学式根据化合物中元素的质量比(或元素的质量分数比)求化学式,其方法是通过元素的相对原子质量来推断化学式。通过组成元素质量比或元素的质量分数进行分式变换,转换成原子个数(比),推测化学式。
(2)根据某化合物中元素的质量比确定元素的化合价已知某化合物中元素的质量比确定某元素的化合价,可通过元素的质量比及元素的相对原子质量推断化学式中元素的原子个数之比,再根据化合物中正负化合价代数和为零的原则确定元素的化合价。
(3)根据元素的质量比确定元素的相对原子质量
化合物中元素的质量比等于相对原子质量与原子个数的乘积比,利用元素的质量比及化合物中各原子的个数即可求出元素的相对原子质量。相对原子质量之比等于元素的质量除以其原子个数所得的数值之比。
(4)物质的质量比与分子个数比之间的换算:
换算关系:物质的质量比 分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为
分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为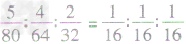 =1:1:1
=1:1:1
利用化学式变形求物质的质量比:
例:含有相同质量铁元素的Fe2O3和Fe3O4的质量比是多少?
解析:设含有相同质量铁元素的Fe2O3和Fe3O4的质量分别为x,y,为了使两者含铁元素的质量相等,可以将它们的化学式变形为铁原子数目相等的式子:
Fe2O3→Fe6O9 Fe3O4→Fe6O8
480 464
x y
x:y=480:464=30:29
答案:30:29
化合物里各元素的质量比是原子个数与相对原子质量的乘积之比。即各元素原子的相对原子质量总和之比。计算的关键在于正确判断出各元素的原子总数。
公式:
各元素的质量比=各元素相对原子质量与相应原子个数的乘积之比。如化学式为AmBn的物质中,A、B两元素的质量比 =(A的相对原子质量×m):(B的相对原子质量×n)。
对概念公式的理解:
(1)元素是宏观概念,只讲种类,不讲个数。用元素符号表示时,7C素符号前后都不能写数字,如计算四氧化三铁(Fe3O4)中铁元素和氧元素的质量比时不能写成3Fe:4O
(2)在化学式中,原子个数比等于元素的质量除以其相对原子质量之比。如AmBn中A,B两元素的质量比为M:N,则化学式中A,B两元素的原子个数比m:n=

(3)当化学式中含有多种元素时,根据化学式可以计算出全部元素的质量比,也可以计算出其中某几种元素的质量比。
化学式中元素质量比的变式运算:
在AmBn中元素A,B的质量比等于各元素的相对原子质m与原子个数的乘积比,即A,B元素质量比= (A的相对原子质量×m):(B的相对原子质量×n),根据元素质量比的变形运算主要有:
(1)根据某化合物中元素的质最比求化学式根据化合物中元素的质量比(或元素的质量分数比)求化学式,其方法是通过元素的相对原子质量来推断化学式。通过组成元素质量比或元素的质量分数进行分式变换,转换成原子个数(比),推测化学式。
(2)根据某化合物中元素的质量比确定元素的化合价已知某化合物中元素的质量比确定某元素的化合价,可通过元素的质量比及元素的相对原子质量推断化学式中元素的原子个数之比,再根据化合物中正负化合价代数和为零的原则确定元素的化合价。
(3)根据元素的质量比确定元素的相对原子质量
化合物中元素的质量比等于相对原子质量与原子个数的乘积比,利用元素的质量比及化合物中各原子的个数即可求出元素的相对原子质量。相对原子质量之比等于元素的质量除以其原子个数所得的数值之比。
(4)物质的质量比与分子个数比之间的换算:
换算关系:物质的质量比
 分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为
分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为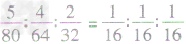 =1:1:1
=1:1:1利用化学式变形求物质的质量比:
例:含有相同质量铁元素的Fe2O3和Fe3O4的质量比是多少?
解析:设含有相同质量铁元素的Fe2O3和Fe3O4的质量分别为x,y,为了使两者含铁元素的质量相等,可以将它们的化学式变形为铁原子数目相等的式子:
Fe2O3→Fe6O9 Fe3O4→Fe6O8
480 464
x y
x:y=480:464=30:29
答案:30:29
定义:
物质中某元素的质量分数,就是该元素的质量与组成物质的各元素总质量之比。
公式:
某元素的质量分数=
如AmBn中A元素的质量分数=
若题目给出物质的化学式,又同时知道物质的实际质量,则可根据物质的质量×某元素的质量分数=该元素的质量,将其中所含元素的质量求出。同理,物质的质量=某元素质量÷该元素的质量分数。
公式的理解:
计算时应先列式计算,然后代入数据算出结果。如水中氢元素的质量分数=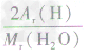 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%而不能写成
×100%=11.1%而不能写成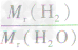 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%
×100%=11.1%
化学式中质量分数的应用:
①已知物质的质量求所含的某元素的质量
利用公式:元素的质量=物质的质量×该元素的质量分数
②已知元素的质量求物质的质量
利用公式:物质的质量=元素的质量÷该元素的质量分数
③根据元素的质量分数确定物质的化学式
利用化学式的变形比较元素质量分数的大小:
例: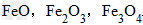 三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?
三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?
解析:三种含铁的氧化物的化学式可变形为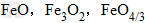 ,则三种含铁的氧化物中铁元素的质量分数分别为:
,则三种含铁的氧化物中铁元素的质量分数分别为: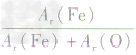 、
、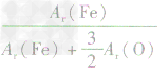 、
、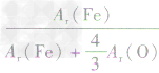 ,通过比较分母可知:
,通过比较分母可知: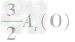 >
>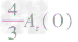 >Ar(O),故铁元素的质量分数由大到小排列的顺序为
>Ar(O),故铁元素的质量分数由大到小排列的顺序为 。
。
物质中某元素的质量分数,就是该元素的质量与组成物质的各元素总质量之比。
公式:
某元素的质量分数=

如AmBn中A元素的质量分数=

若题目给出物质的化学式,又同时知道物质的实际质量,则可根据物质的质量×某元素的质量分数=该元素的质量,将其中所含元素的质量求出。同理,物质的质量=某元素质量÷该元素的质量分数。
公式的理解:
计算时应先列式计算,然后代入数据算出结果。如水中氢元素的质量分数=
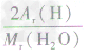 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%而不能写成
×100%=11.1%而不能写成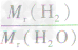 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%
×100%=11.1%化学式中质量分数的应用:
①已知物质的质量求所含的某元素的质量
利用公式:元素的质量=物质的质量×该元素的质量分数
②已知元素的质量求物质的质量
利用公式:物质的质量=元素的质量÷该元素的质量分数
③根据元素的质量分数确定物质的化学式
利用化学式的变形比较元素质量分数的大小:
例:
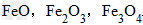 三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?
三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?解析:三种含铁的氧化物的化学式可变形为
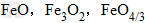 ,则三种含铁的氧化物中铁元素的质量分数分别为:
,则三种含铁的氧化物中铁元素的质量分数分别为: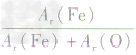 、
、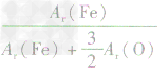 、
、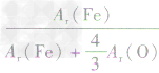 ,通过比较分母可知:
,通过比较分母可知: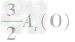 >
>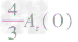 >Ar(O),故铁元素的质量分数由大到小排列的顺序为
>Ar(O),故铁元素的质量分数由大到小排列的顺序为 。
。 发现相似题
与“被霉菌污染的粮食易产生黄曲霉素(C17H12O6).下列说法中错...”考查相似的试题有:
- 无铅汽油一般是加入甲基叔丁基醚【CH3OC(CH3)3】作为高辛烷值组分.下列关于甲基叔丁基醚叙述错误的是( )A.甲基叔丁基醚...
- 济南市的露天烧烤正是因为有庞大的市场,所以才屡禁不止.科学研究表明,肉类在烧烤过程中会产生一种极其强烈的致癌物--苯并...
- 目前世界上已证明“达菲”是治疗禽流感和甲型H1N1流感的一个良方. 达菲的生产原材料是八角中所含的一种重要成分莽草酸(化学式...
- (1)双氧水(H2O2)既是工业上重要的绿色氧化剂,又是常用的医用消毒剂.双氧水(H2O2)中氢、氧两种元素的质量比是______;...
- 赣南脐橙是江西著名土特产之一,肉质脆嫩、入口化渣,浓甜芳香,含有丰富的维生素C和维生素P(化学式为C27H30O16),可以增加...
- 下图为某医用葡萄糖注射液商标的一部分,下列说法不正确的是5%葡萄糖(C6H12O6)注射液性状:本品为无色透明液体,密度1g/mL...
- 钙是人体必须的常量元素,每日必须摄入足够量的钙。目前市场上的补钙药剂很多,右图是某种品牌的补钙药品的部分说明书。请回...
- 人体缺乏维生素C(简写VC)就会患坏血病.图为某品牌维生素C片说明书的一部分.根据信息进行的下列计算,错误的是( )A.每...
- 近几年脑黄金(DHA)成为人们研究的热点之一.脑黄金在医药、食品行业中前景非常广阔,脑黄金的化学式为C25H51COOH,试计算:...
- (1)经过防治“非典”的洗礼,我国公民的公共卫生意识和防病健身意识普遍提高.过氧乙酸是防治“非典”中常用的高效消毒剂,它的...