本试题 “新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下...” 主要考查您对原电池原理
电解池原理
酯
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 原电池原理
- 电解池原理
- 酯
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例

(1)装置图:
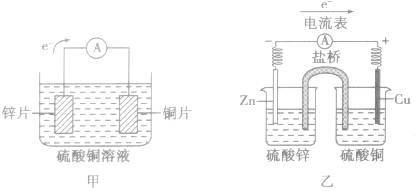
(2)原理图:
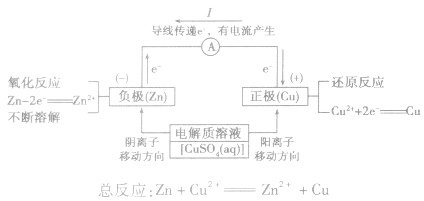
3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
原电池中的电荷流动:
在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子 (带负电荷)向负极移动。这样形成了电荷持续定向流动,电性趋向平衡的闭合电路。
(1)电解:使电流通过电解质溶液且在阴、阳极两极引起氧化还原反应的过程叫电解。
(2)装置:电解池(电解槽)
(3)特点:将电能转化为化学能。
形成条件:①与电源相连的两个电极,②电解质溶液或熔融电解质,③形成闭合回路
(4)阴离子放电顺序:S2->I->Br->Cl->OH->SO42->NO3->F- 阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
(5)电解时溶液pH值的变化规律电解质溶液在电解过程中,有时溶液pH值会发生变化。判断电解质溶液的pH值变化,有时可以从电解产物上去看。
①若电解时阴极上产生H2(消耗H+),阳极上无O2产生,电解后溶液pH值增大;
②若阴极上无H2,阳极上产生O2,则电解后溶液pH值减小;
③若阴极上有H2,阳极上有O2,且(相当于电解水),则有三种情况:
a如果原溶液为中性溶液,则电解后pH值不变;
b如果原溶液是酸溶液,则pH值变小;
c如果原溶液为碱溶液,则pH值变大;
④若阴极上无H2,阳极上无O2产生,电解后溶液的pH可能也会发生变化。如电解CuCl2溶液(CuCl2溶液由于Cu2+水解显酸性),一旦CuCl2全部电解完,pH值会变大,成中性溶液。
(6)电解反应类型:从参加反应的物质来分电解反应可分成五类:
①H2O型:实质是电解水。如电解硝酸钠、氢氧化钠、硫酸等溶液。
②溶质型:溶质所电离出来的离子发生氧化还原,如电解氯化铜、溴化氢等溶液。
③硫酸铜溶液型:电解产物是金属、氧气与酸。如电解硫酸铜溶液生成单质铜、氧气和硫酸,电解硝酸银溶液时生成单质银、氧气和硝酸。
④氯化钠溶液型:电解产物是非金属单质、氢气与碱。如电解氯化钠溶液时生成氯气、氢气和氢氧化钠,电解溴化钾溶液时生成溴单质、氢气和氢氧化钾。
⑤电镀型:镀层金属作阳极,阳极反应是:M-ne-=Mn+,镀件作阴极,阴极反应是:Mn++ne-=M。(电解精炼与电镀,实质上是相同的)
原电池、电解池、电镀池的比较:


1.概念及通式:
酸(羧酸或无机含氧酸)和醇起反应生成的一类化合物叫酯。如:
酯的通式为
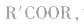 官能团是
官能团是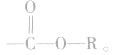 饱和一元羧酸和饱和一元醇形成的酯的通式为
饱和一元羧酸和饱和一元醇形成的酯的通式为 (n≥2),所以这种酯与碳原子数相同的饱和一元羧酸及羟基醛互为同分异构体,与多1个碳原子的饱和一元醇的相对分子质量相等。
(n≥2),所以这种酯与碳原子数相同的饱和一元羧酸及羟基醛互为同分异构体,与多1个碳原子的饱和一元醇的相对分子质量相等。2.分类
根据生成酯的酸的不同,酯可分为有机酸酯和无机酸酯,通常所说的酯是指有机酸(羧酸)酯。
3.书写及命名——某酸某酯
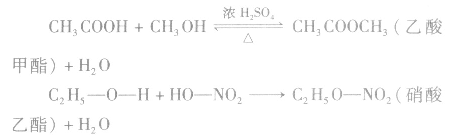
根据生成酯的酸和醇对酯进行命名:如:

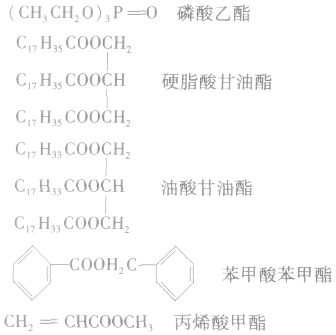
4.酯的存在酯类广泛存在于自然界中,如苹果里含有戊酸戊酯,香蕉里含有乙酸异戊酯等。
酯的性质:
1.酯的物理性质
低级酯是具有芳香气味的液体,密度一般小于水,并难溶于水,易溶于有机溶剂。
2.酯的化学性质
在酸或碱催化的条件下,酯可以发生水解反应,能得到相应的酸和醇。酯在酸性条件下的水解反应是可逆反应。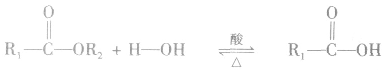
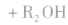
酯在碱性条件下的水解程度大于在酸性条件下的水解程度,其主要原因是在碱性条件下,酯水解生成的羧酸可以与碱发生反应,使羧酸浓度减小,即减小了生成物的浓度,化学平衡向正反应方向移动,使酯的水解程度增大。
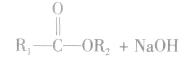
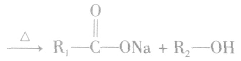
3.酯的用途酯具有广泛的用途。很多香精、药物本身就是酯。例如,广泛用于农业生产和家庭除虫的低毒高效杀虫药拟除虫菊酯就是一种酯,某些抗生素如红霉素为大环内酯类抗生素,也属于酯。日常生活中的饮料、糖果和糕点等常使用酯类物质作为香料。液态的酯可用作有机溶剂。
酯化反应的规律归纳:
1.酯化反应中量的变化
(1)酯化反应发生时,每有1mol酯基“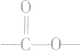 ”生成,必生成1molH2O。根据质量守恒有:反应物巾各元素原子数=生成物中各元素原子数;m(酸)+m(醇)=m(酯)+m(H2O)。
”生成,必生成1molH2O。根据质量守恒有:反应物巾各元素原子数=生成物中各元素原子数;m(酸)+m(醇)=m(酯)+m(H2O)。
2.酯化反应前后碳链结构的变化规律
在下列一系列变化中,分子中的碳链结构不变:醇 醛
醛 羧酸
羧酸 酯,酯键两侧的碳骨架仍保持着醇的碳架和羧酸的碳架。醇与它自身氧化成的羧酸反应生成的酯,酯键两侧碳骨架相同。
酯,酯键两侧的碳骨架仍保持着醇的碳架和羧酸的碳架。醇与它自身氧化成的羧酸反应生成的酯,酯键两侧碳骨架相同。
3.酯化反应的反应条件
酯化反应是可逆反应,逆反应是酯的水解。羧酸和醇的酯化反应速率很慢,冈此,酯化反应通常要在加热并加催化剂(浓硫酸)的条件下进行。之所以用浓硫酸而不用稀硫酸是因为浓硫酸除起催化作用外,还可作吸水剂吸收酯化反应生成的水,有利于反应向生成酯的方向进行。酯化反应巾的浓硫酸,可用浓磷酸
与“新型锂离子电池在新能源的开发中占有重要地位。可用作节能环...”考查相似的试题有:
- 结合下图判断,下列叙述正确的是[ ]A.I和Ⅱ中正极均被保护B.I和Ⅱ中负极反应均是Fe - 2e-=Fe2+C.I和Ⅱ中正极反应均是O2+2H2O+4e-...
- 某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。(1)将上述反应设计成的原电池如图甲所示,请回答下列问题: ①图中X溶...
- 市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质...
- 原电池是一种______装置.电子的流动方向是从______极到______极;电流方向是从______极到______极.电工操作中规定,不能把...
- (20分)如图为相互串联的甲乙两个电解池,请回答:(1)若甲池为电解精炼粗铜(含有锌铁镍银金和铂等微量杂质,杂质发生的电...
- 常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均为零),电池反应通常表示为LaNi5H6+6NiO(OH)LaNi5+6Ni(OH)2...
- 人工固氮是指将氮元素由游离态转化为化合态的过程。I.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定...
- 对原电池的电极名称,下列叙述中错误的是( )A.电子流入的一极为正极B.比较不活泼的一极为正极C.电子流出的一极为负极D....
- 如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法正确的...
- 除去乙酸乙酯中含有的乙酸,最好的处理方法是A.蒸馏B.用足量饱和碳酸钠溶液洗涤后分液C.水洗后分液D.用饱和食盐水洗涤后分液