本试题 “铝土矿(主要成分为Al2O3、SiO2、 Fe2O3)是提取氧化铝的原料。提取氧化铝的工艺流程如下:(1)写出铝土矿与浓NaOH溶液反应的离子方程式:___________。(2)写出...” 主要考查您对氧化铝
偏铝酸盐
二氧化硅
工业生产其他物质(工业制备碳酸锂,硫酸钡等化工原理)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化铝
- 偏铝酸盐
- 二氧化硅
- 工业生产其他物质(工业制备碳酸锂,硫酸钡等化工原理)
氧化铝的性质:
- 物理性质:白色固体,熔点高,是较好的耐火材料,天然的Al2O3叫刚玉,硬度仅次于金刚石;
- 化学性质:不溶于水的两性化合物,既能与酸反应,又能与强碱反应。
(1)与酸反应: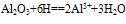
(2)与碱反应:
氧化铝的两性:
氧化铝属于两性氧化物,既能与酸反应,也能与强碱反应:
Al2O3+6H+===2Al3++3H2O
Al2O3+2OH-===2AlO2-+H2O
氧化铝与氧化镁的比较:
| 氧化物 | MgO | Al2O3 | |
| 工业制备 | MgCO3=(煅烧)=MgO+CO2↑ | 铝土矿——Al2O3 | |
| 中央物理性质 | 白色固体,熔点高,密度小 | 白色固体,熔点高,密度较小 | |
| 主要化学性质 | H2O | MgO+H2O==Mg(OH)2,很慢 | 不溶解,也不反应 |
| H+ | MgO+2H+==Mg2++H2O | Al2O3+6H+==2Al3++3H2O | |
| OH- | 不反应 | Al2O3+2OH-==2AlO2-+H2O | |
| 重要用途 | 制造耐火、耐高温器材 | 制造耐火、耐高温器材;工业冶炼铝 | |
偏铝酸盐:
偏铝酸盐是指含有“AlO2-”集团的盐,是铝及其氧化物与强碱反应的产物。
例如Al(OH)3+OH-═AlO2-+2H2O。
偏铝酸盐的性质用离子方程式表示如下: ①偏铝酸盐溶液发生水解反应,溶液呈碱性。 ALO2-+2H2O==AL(OH)3+OH- ②偏铝酸盐与酸反应与强酸发生反应:适量强酸:ALO2-+H+H2O==AL(OH)3 过量强酸:ALO2-+4H+==AL3++2H2O 与弱酸(H2CO3)发生反应:即通入CO2气适量CO2:2ALO2-+CO2+3H2O==2AL(OH)3+CO32- 过量CO2:ALO2-+CO2+2H2O==AL(OH)3+HCO3- ③铝盐与偏铝酸盐溶液反应: AL3++3ALO2-+6H2O==4AL(OH)3 偏铝酸盐也可以理解为两性物质Al盐偏碱性的盐。AlO2-+H+(少量)+H2O==Al(OH)3↓
AlO2-+4H+(过量)==Al3++2H2O
偏铝酸盐的性质:
偏铝酸盐的性质用离子方程式表示如下:
①偏铝酸盐溶液发生水解反应,溶液呈碱性。AlO2-+2H2O==Al(OH)3+OH-
②偏铝酸盐与酸反应与强酸发生反应:
适量强酸:AlO2-+H++H2O==Al(OH)3
过量强酸:AlO2-+4H+==Al3++2H2O
与弱酸(H2CO3)发生反应:即通入适量CO2:2AlO2-+CO2+3H2O==2Al(OH)3+CO32-
过量CO2:AlO2-+CO2+2H2O==Al(OH)3+HCO3-
③铝盐与偏铝酸盐溶液反应:Al3++3AlO2-+6H2O==4Al(OH)3偏铝酸盐也可以理解为两性物质Al盐偏碱性的盐。
方法与技巧:
偏铝酸盐是在强碱性条件下生成的,所以它的存在环境也是强碱性环境,在离子共存题目中,经常遇到含有AlO2-的情况,遇到这样的题目,我们可以认为该溶液中含有OH-,与很多显酸性的离子不共存。例如:AlO2-与Al3+、Fe3+、NH4+、HCO3-等常见离子不共存。
“铝三角”关系:
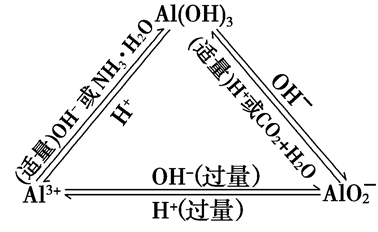
Al3++3OH-===Al(OH)3↓
Al(OH)3+OH-===AlO2-+2H2O
Al3++4OH-===AlO2-+2H2O
AlO2-+2H2O+CO2===Al(OH)3↓+HCO3-
AlO2-+H++H2O===Al(OH)3↓
AlO2-+4H+===Al3++2H2O
二氧化硅:
①化学式SiO2
②相对分子质量:60
③类别:酸性氧化物
④晶体类型:原子晶体
⑥晶体中粒子间的作用力:共价键
二氧化硅的物理性质和化学性质:
(1)物理性质:无色透明或白色粉末,原子晶体,熔沸点都很高,坚硬难熔,不溶于水,天然的二氧化硅俗称硅石,是构成岩石的成分之一。
(2)化学性质:不活泼
①不与水反应,不能跟酸(氢氟酸除外)发生反应。
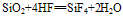 (氢氟酸不能盛放在玻璃容器中)。
(氢氟酸不能盛放在玻璃容器中)。②具有酸性氧化物的性质,能跟碱性氧化物或强碱反应。
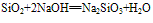 (实验室中盛放碱液的试剂瓶用橡胶塞而不用玻璃塞的原因)
(实验室中盛放碱液的试剂瓶用橡胶塞而不用玻璃塞的原因)
 (制玻璃)
(制玻璃)③具有弱氧化性


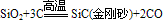
知识点拨:
二氧化硅晶体的结构若在硅晶体结构中的每个Si—Si键中“插入”一个氧原子,便可得到以硅氧四面体 (SiO4)为骨架的二氧化硅的结构,如图所示。在二氧化硅晶体里,硅原子和氧原子交替排列,不会出现Si—Si键和O—O键,即每个硅原子与四个氧原子形成四个共价键,每个氧原子与两个硅原子形成共价键,因此,二氧化硅晶体中硅原子和氧原子的个数比为1:2,二氧化硅的化学式为SiO2.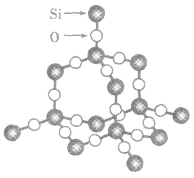
二氧化硅的用途:
①光导纤维的主要原料
②石英的主要成分是SiO2,纯净的石英可用来制造石英玻璃。石英晶体中有时含有其他元素的化合物,它们以溶解状态存在于石英中,呈各种颜色。纯净的SiO2晶体叫做水晶,它是六方柱状的透明晶体,是较贵重的宝石。 水晶常用来制造电子工业中的重要部件、光学仪器,也用来制造高级工艺品和眼镜片。
③玛瑙石含有有色杂质的石英晶体,可用于制造精密仪器轴承,耐磨器皿和装饰品。
1.确定化工生产的最佳过程
确定化工生产反应原理与过程的一般方法:对于某一具体的化工产品,研究生产过程要从产品的化学组成和性质考虑,来确定原料和生产路线。
①分析产品的化学组成,据此确定生产产品的主要原料;
②分析产品与生产原料之间关键元素的性质,确定主要生产步骤;
③分析生产原料的性质.确定反应原理。
2.选择化工生产的最佳原料
选择原料首先要考虑化学反应原理,此外还要考虑厂址选择、原料供应、能源供应、工业用水供应、产品存储、产品运输、产品预处理成本、环境保护等。
3.控制最佳化学反应条件
控制反应条件是取得化工生产最佳综合效益的重要环节之一。控制反应条件要应用化学反应速率理论和化学平衡原理,结合具体化学反应的特点以及生产技术和设备条件、能源消耗等,控制最佳化学反应速率和反应物的平衡转化率。
4.科学治理工业“三废”
“三废”主要是指废气、废液和废渣。治理“三废” 首先要从设计生产工艺与选择原料做起,即从源头上解决问题;其次是把好排放关,对排出的“三废”的处理,要尽最大努力使其资源化,最低要求是无害化。
5.充分利用“废热”
通过热交换或其他方式利用化学反应所放出的热量。
硫代硫酸钠的工业制法:
(1)亚硫酸钠
将纯碱溶解后,与(硫磺燃烧生成的)二氧化硫作用生成亚硫酸钠,再加入硫磺沸腾反应,经过滤、浓缩、结晶,制得硫代硫酸钠。
Na2CO3+SO2==Na2SO3+CO2 Na2SO3+S+5H2O==Na2S2O3·5H2O
(2)硫化碱法
利用硫化碱蒸发残渣、硫化钡废水中的碳酸钠和硫化钠与硫磺废气中的二氧化硫反应,经吸硫、蒸发、结晶,制得硫代硫酸钠。
2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2
(3)氧化、亚硫酸钠和重结晶法
由含硫化钠、亚硫酸钠和烧碱的液体经加硫、氧化;亚硫酸氢钠经加硫及粗制硫代硫酸钠重结晶三者所得硫代硫酸钠混合、浓缩、结晶,制得硫代硫酸钠。
2Na2S+2S+3O2==2Na2S2O3 Na2SO3+S==Na2S2O3
(4)重结晶法
将粗制硫代硫酸钠晶体溶解(或用粗制硫代硫酸钠溶液),经除杂,浓缩、结晶,制得硫代硫酸钠。
砷碱法净化气体副产 利用焦炉煤气砷碱法脱硫过程中的下脚(含Na2S2O3),经吸滤、浓缩、结晶后,制得硫代硫酸钠。
高锰酸钾的工业制法:
工业上利用二氧化锰制备高锰酸钾,其步骤是
(1)二氧化锰与氢氧化钾共熔并通入氧气:2MnO2+4KOH+O2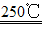 2K2MnO4+2H2O
2K2MnO4+2H2O
(2)电解锰酸钾溶液:2K2MnO4+2H2O 2KMnO4+H2↑+2KOH
2KMnO4+H2↑+2KOH
高锰酸钾常见的制备方法有以下两矿石中取得的二氧化锰和氢氧化钾在空气中或混合硝酸钾(提供氧气)加热,产生锰酸钾,再于碱性溶液中与氧化剂进行电解氧化得到高锰酸钾。 2MnO2+4KOH+O2→2K2MnO4+2H2O 2K2MnO4+Cl2→2KMnO4+2KCl
也可以用MnSO4在酸性环境中和二氧化铅(PbO2)或铋酸钠(NaBiO3)等强氧化剂反应产生。此反应也用于检验二价锰离子的存在,因为高锰酸钾的颜色明显种:
①法一:以MnO2(软锰矿)为原料制KMnO4
第一步:Mn(IV)→Mn(VI) 2MnO2+4KOH+O2====2K2MnO4+2H2O
第二步:CO2歧化K2MnO4 K2MnO4+2CO2====2KMnO4+MnO2+2K2CO3
这种制备方法的最高产率为66.7% 法
②电解法:阳极:2MnO42--2e-→2MnO4- 阴极:2H2O+2e-→H2↑+2OH- 总电解反应方程式为2K2MnO4+2H2O→2KMnO4+2KOH+H2↑
理论产率可达100%
纯硅的制取:
工业上在电炉内,用硅石和碳反应得粗硅和一氧化碳,然后用粗硅和氯气反应得四氯化硅,再用四氯化硅和氢气反应的纯硅和氯化氢,这样就完成硅的制造。(第一步完全相同,第二部有三种方法,工业上用的的是西门子的方法,其他两种不常见。)反应方程式
(1)石英制硅(冶金级),这一步是粗硅制取硅商业上是由高纯度的石英砂和木头,焦炭和煤使用碳棒电极在电弧炉中制得。在高于1900°C的温度下,依照下列方程式碳把石英砂还原成硅: SiO2+C→Si+CO2. SiO2+2C→Si+2CO. 这一过程所的硅称为冶金级硅。纯度为98%-99%。另外,硅制备办法还有熔盐电解法,即电解熔解的二氧化硅。
(2)高纯硅的制备在制备高纯硅之前,需要把粗硅转化成三氯化氢硅(300°C): Si+3HCl→HSiCl3+H2 接着,通过精馏使SiHCl3与其它氯化物分离,经过精馏的SiHCl3,其杂质水平可低于10-10%的电子级硅要求。然后,提纯后的SiHCl3通过CVD原理在1150°C下制备出多晶硅粉。2HSiCl3→Si+2HCl+SiCl4.
与“铝土矿(主要成分为Al2O3、SiO2、 Fe2O3)是提取氧化铝的原料。...”考查相似的试题有:
- 由稀盐酸、NaOH溶液、Al2O3、Mg、Cl2两两之间在一定条件下反应(溶液反应在常温下进行),可制得的正盐有[ ]A.6种B.5种C.4...
- 已知:下列各种物质都由1~18号元素组成,它们之间的关系如下图所示。常温下,A、F为金属单质,J是液体,F既能与L溶液反应,又...
- 下图中,A、C是工业上上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重...
- 下列有关物质的性质及应用说法错误的是( )A.SiO2具有导电性,可用于制造半导体材料B.Cl2能与石灰乳反应,可用于制取漂白...
- A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一 种元素。在一定条件下相互转化关系如下图所示(部分产物已略去)...
- 下列说法不正确的是[ ]A. SiO2既能溶于NaOH溶液,又能与氢氟酸反应,属于两性氧化物B. 电解熔融NaCl或其水溶液都可制得Cl2C. ...
- 下列关于碳和硅的叙述不正确的是[ ]A.金刚石和晶体硅都是由原子构成的物质B.地壳中硅元素比碳元素含量多C.自然界里含碳元素化...
- 某氧化物难溶于水,可溶于熔化的烧碱中,生成易溶于水的化合物。在该化合物的溶液中,逐滴滴入盐酸,立即生成白色沉淀,且逐...
- 高铁酸钾是一种高效多功能水处理剂。工业上常采用NaClO氧化法生产,反应原理为:① 在碱性条件下,利用NaClO氧化Fe(NO3)3制得N...
- 工业上制取CuCl2的生产流程如图请结合下表数据,回答问题:(1)溶液A中加入X是一种“绿色”氧化剂,则X是____(填化学式),其目...