本试题 “配位平衡也是一种相对平衡状态,存在着平衡移动,它同溶液的pH值、沉淀的反应、氧化还原反应等有密切关系,也就是说,在溶液中形成配位物时,常常出现颜色的...” 主要考查您对影响化学平衡的因素
化学科学探究
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 影响化学平衡的因素
- 化学科学探究
影响化学平衡的因素:
(1)浓度在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使化学平衡向正反应方向移动;增大生成物的浓度或减小反应物的浓度,都可以使化学平衡向逆反应方向移动。
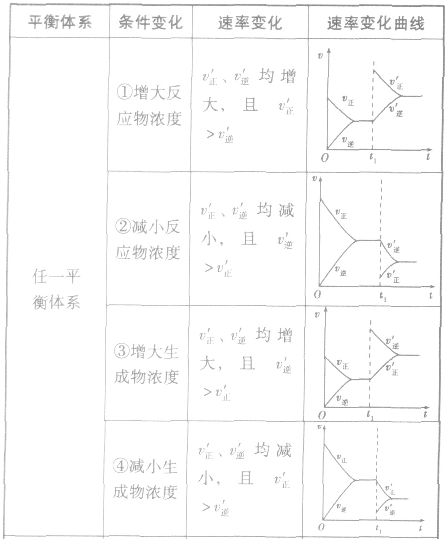
(2)压强对反应前后气体总体积发生变化的反应,在其他条件不变时,增大压强会使平衡向气体体积缩小的方向移动,减小压强会使平衡向气体体积增大的方向移动。对于反应 来说,加压,
来说,加压,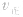 增大、
增大、 增大,
增大,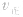 增大的倍数大,平衡向正反应方向移动:若减压,
增大的倍数大,平衡向正反应方向移动:若减压,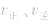 均减小,
均减小,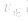 减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图:
减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图:
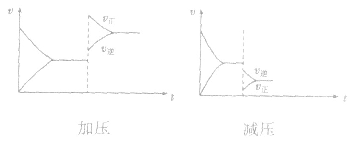
(3)温度在其他条件不变时,温度升高平衡向吸热反应的方向移动,温度降低平衡向放热反应的方向移动
对于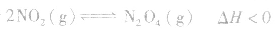 ,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图:
,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图:
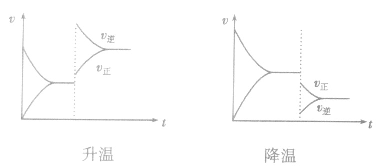
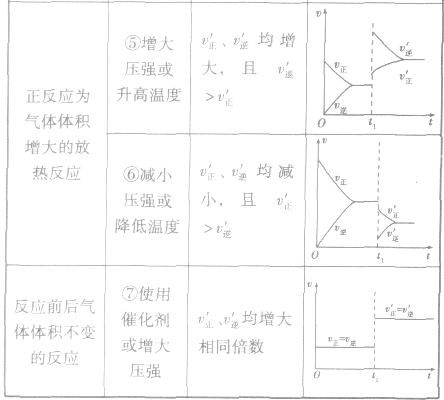
(4)催化剂由于催化剂能同等程度地改变正、逆反应速率,所以催化剂对化学平衡无影响,v一t图像为
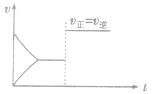
稀有气体对化学反应速率和化学平衡的影响分析:
1.恒温恒容时
充入稀有气体 体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。
体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。
2.恒温恒压时
充入稀有气体 容器容积增大
容器容积增大 各反应成分浓度降低
各反应成分浓度降低 反应速率减小,平衡向气体体积增大的方向移动。
反应速率减小,平衡向气体体积增大的方向移动。
3.当充入与反应无关的其他气体时,分析方法与充入稀有气体相同。
化学平衡图像:
1.速率一时间因此类图像定性揭示了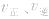 随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
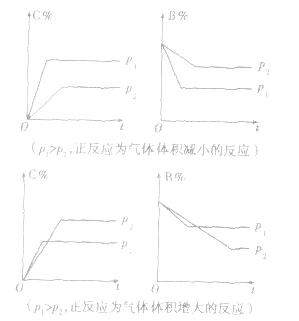
2.含量一时间一温度(压强)图常见的形式有下图所示的几种(C%指某产物百分含量,B%指某反应物百分含量),这些图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高低(大小),水平线高低反映平衡移动的方向。

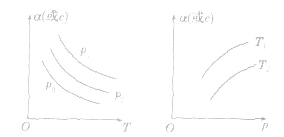
3.恒压(温)线该类图像的纵坐标为物质的平衡浓发(c)或反应物的转化率(α),横坐标为温度(T)或压强 (p),常见类型如下图:
小结:
1.图像分析应注意“三看”
(1)看两轴:认清两轴所表示的含义。
(2)看起点:从图像纵轴上的起点,一般可判断谁为反应物,谁为生成物以及平衡前反应进行的方向。
(3)看拐点:一般图像在拐点后平行于横轴则表示反应达平衡,如横轴为时间,由拐点可判断反应速率。
2.图像分析中,对于温度、浓度、压强三个因素,一般采用“定二议一”的方式进行分析
平衡移动方向与反应物转化率的关系:
1.温度或压强改变引起平衡向正反应方向移动时,反应物的转化率必然增大。
2.反应物用量的改变
(1)若反应物只有一种时,如aA(g) bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:

(2)若反应物不止一种时,如aA(g)+bB(g) cC(g)+dD(g):
cC(g)+dD(g):
a.若只增加A的量,平衡向正反应方向移动,而A的转化率减小,B的转化率增大。
b.若按原比例同倍数的增加反应物A和B的量,则平衡向正反应方向移动,而反应物的转化率与气体物质的计量数有关:

c.若不同倍增加A、B的量,相当于增加了一种物质,同a。
3.催化剂不改变转化率。
4.反应物起始的物质的量之比等于化学计量数之比时,各反应物转化率相等。
浓度、压强影响化学平衡的几种特殊情况:
1.当反应混合物中存在固体或纯液体物质时,由于其“浓度”是恒定的,不随其量的增减而变化,故改变这些固体或纯液体的量,对平衡基本无影响。
2.南于压强的变化对非气态物质的浓度基本无影响,因此,当反应混合物中不存在气态物质时,压强的变化对平衡无影响。
3.对于气体分子数无变化的反应,如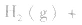
 ,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。
,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。
4.对于有气体参加的反应,同等程度地改变反应混合物中各物质的浓度,应视为压强对平衡的影响,如某平衡体系中,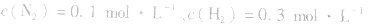 ,
,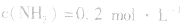 ,当浓度同时增大一倍时,即让
,当浓度同时增大一倍时,即让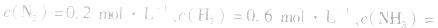
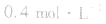 ,此时相当于压强增大一倍,平衡向生成NH3的方向移动。
,此时相当于压强增大一倍,平衡向生成NH3的方向移动。
5.在恒容的密闭容器中,当改变其中一种气体物质的浓度时,必然同时引起压强改变,但判断平衡移动的方向时,心仍从浓度的影响去考虑:如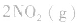
 ,平衡后,向容器中再通入反应物
,平衡后,向容器中再通入反应物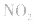 ,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小
,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小
(1)浓度在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使化学平衡向正反应方向移动;增大生成物的浓度或减小反应物的浓度,都可以使化学平衡向逆反应方向移动。
(2)压强对反应前后气体总体积发生变化的反应,在其他条件不变时,增大压强会使平衡向气体体积缩小的方向移动,减小压强会使平衡向气体体积增大的方向移动。对于反应
 来说,加压,
来说,加压,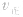 增大、
增大、 增大,
增大,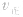 增大的倍数大,平衡向正反应方向移动:若减压,
增大的倍数大,平衡向正反应方向移动:若减压,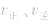 均减小,
均减小,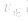 减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图:
减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图:
(3)温度在其他条件不变时,温度升高平衡向吸热反应的方向移动,温度降低平衡向放热反应的方向移动
对于
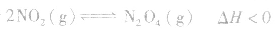 ,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图:
,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图:
(4)催化剂由于催化剂能同等程度地改变正、逆反应速率,所以催化剂对化学平衡无影响,v一t图像为

稀有气体对化学反应速率和化学平衡的影响分析:
1.恒温恒容时
充入稀有气体
 体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。
体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。 2.恒温恒压时
充入稀有气体
 容器容积增大
容器容积增大 各反应成分浓度降低
各反应成分浓度降低 反应速率减小,平衡向气体体积增大的方向移动。
反应速率减小,平衡向气体体积增大的方向移动。3.当充入与反应无关的其他气体时,分析方法与充入稀有气体相同。
化学平衡图像:
1.速率一时间因此类图像定性揭示了
 随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。

2.含量一时间一温度(压强)图常见的形式有下图所示的几种(C%指某产物百分含量,B%指某反应物百分含量),这些图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高低(大小),水平线高低反映平衡移动的方向。


3.恒压(温)线该类图像的纵坐标为物质的平衡浓发(c)或反应物的转化率(α),横坐标为温度(T)或压强 (p),常见类型如下图:

小结:
1.图像分析应注意“三看”
(1)看两轴:认清两轴所表示的含义。
(2)看起点:从图像纵轴上的起点,一般可判断谁为反应物,谁为生成物以及平衡前反应进行的方向。
(3)看拐点:一般图像在拐点后平行于横轴则表示反应达平衡,如横轴为时间,由拐点可判断反应速率。
2.图像分析中,对于温度、浓度、压强三个因素,一般采用“定二议一”的方式进行分析
平衡移动方向与反应物转化率的关系:
1.温度或压强改变引起平衡向正反应方向移动时,反应物的转化率必然增大。
2.反应物用量的改变
(1)若反应物只有一种时,如aA(g)
 bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
(2)若反应物不止一种时,如aA(g)+bB(g)
 cC(g)+dD(g):
cC(g)+dD(g): a.若只增加A的量,平衡向正反应方向移动,而A的转化率减小,B的转化率增大。
b.若按原比例同倍数的增加反应物A和B的量,则平衡向正反应方向移动,而反应物的转化率与气体物质的计量数有关:

c.若不同倍增加A、B的量,相当于增加了一种物质,同a。
3.催化剂不改变转化率。
4.反应物起始的物质的量之比等于化学计量数之比时,各反应物转化率相等。
浓度、压强影响化学平衡的几种特殊情况:
1.当反应混合物中存在固体或纯液体物质时,由于其“浓度”是恒定的,不随其量的增减而变化,故改变这些固体或纯液体的量,对平衡基本无影响。
2.南于压强的变化对非气态物质的浓度基本无影响,因此,当反应混合物中不存在气态物质时,压强的变化对平衡无影响。
3.对于气体分子数无变化的反应,如
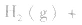
 ,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。
,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。 4.对于有气体参加的反应,同等程度地改变反应混合物中各物质的浓度,应视为压强对平衡的影响,如某平衡体系中,
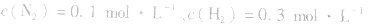 ,
,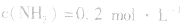 ,当浓度同时增大一倍时,即让
,当浓度同时增大一倍时,即让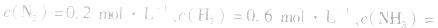
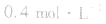 ,此时相当于压强增大一倍,平衡向生成NH3的方向移动。
,此时相当于压强增大一倍,平衡向生成NH3的方向移动。 5.在恒容的密闭容器中,当改变其中一种气体物质的浓度时,必然同时引起压强改变,但判断平衡移动的方向时,心仍从浓度的影响去考虑:如
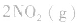
 ,平衡后,向容器中再通入反应物
,平衡后,向容器中再通入反应物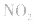 ,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小
,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小化学科学探究:
四个环节:查阅资料、提出假设、实验探究、结论分析
提出问题→猜想假设→制定计划→进行实验→收集证据→解释与结论→反思与评价 →表达与交流
四个环节:查阅资料、提出假设、实验探究、结论分析
提出问题→猜想假设→制定计划→进行实验→收集证据→解释与结论→反思与评价 →表达与交流
发现相似题
与“配位平衡也是一种相对平衡状态,存在着平衡移动,它同溶液的p...”考查相似的试题有:
- (10分)在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g)+B(g)xC(g)+2D(g),2min末...
- 下列叙述中,不能用平衡移动原理解释的是A.红棕色的NO2,加压后颜色先变深后变浅B.黄绿色的氯水光照后颜色变浅C.由H2、Br2...
- 已知可逆反应:A(s)+2B(g)C(g)+D(g) △H
- 在一定条件下,反应2HI(g)⇌H2(g)+I2(g);△H>0,达到化学平衡状态且其他条件不变时:(1)如果升高温度,平衡混合物的...
- 硫元素的化合物在生产、生活中有着广泛的应用。(1)400℃,1.01× Pa下,容积为1.0L的密闭容器中充入0.5molSO2,(g)和0.3 mol...
- (8分)混合物平均摩尔质量通常可表示为:,利用此概念可以讨论许多化学问题:(1)相同条件下,潮湿空气的密度 (选填“>”、“...
- 已知通过乙醇制取氢气有如下两条路线:a.CH3CH2OH(g)+H2O(g)==4H2(g)+2CO(g) △H= +255.6kJ·mol-1b.CH3CH2OH(g)+1/2O2(g)==3...
- 对于可逆反应A(g)+2B(g)2C(g) ΔH>0,下列图象中正确的是
- 某温度下,在固定容积的容器中,可逆反应:A(g)+3B(g)2C(g)达到平衡,测得平衡时各物质的物质的量之比为2:2:1,保持温度、...
- 在合成氨反应中,测得合成塔入口处N2、H2、NH3气体体积比为6∶18∶1,出口处N2、H2、NH3气体体积比为9∶27∶8,则H2的转化率为___...