本试题 “钢铁在生产、生活中有广泛的用途.建造上海世博会的中国馆--“东方之冠”的核心筒就是用四根巨型钢筋混凝土制成的,其中用了大量的钢铁.(1)钢铁属于______(...” 主要考查您对化学反应方程式的书写
文字表达式
纯净物和混合物
合金
金属的冶炼(铁的冶炼)
金属的锈蚀与防护
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应方程式的书写
- 文字表达式
- 纯净物和混合物
- 合金
- 金属的冶炼(铁的冶炼)
- 金属的锈蚀与防护
化学方程式的书写原则遵循两个原则:
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。
化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3 CaO+ CO2↑
CaO+ CO2↑
(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2 CO2
CO2
(3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2 2CuO
2CuO
④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2
 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。 化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
| 常见错误 | 违背规律 |
| 写错物质的化学式 | 客观事实 |
| 臆造生成物或事实上不存在的化学反应 | |
| 写错或漏泄反应条件 | |
| 化学方程式没有配平 | 质量守恒 |
| 漏标多标“↑”、“↓”符号 | —— |
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4
 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。 ③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3
 CaO+ CO2↑
CaO+ CO2↑(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2
 CO2
CO2 (3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2
 2CuO
2CuO ④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
概念:用文字表示化学反应的式子
文字表达式的书写步骤:
(1)写:根据反应事实写出反应物和生成物
(2)注:注明反应条件:[点燃,加热,光照,通电等]
文字表达式的书写步骤:
(1)写:根据反应事实写出反应物和生成物
(2)注:注明反应条件:[点燃,加热,光照,通电等]
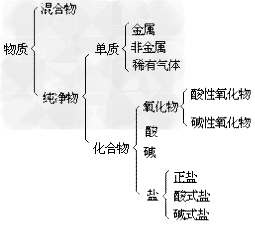
混合物:
(1)概念:由两种或多种物质混合而成的物质,没有有固定的组成,各成分保持自己原有的化学性质。
(3)常见的混合物:空气、合金、矿石、溶液等。
(4)混合物的提纯:混合物经过物理或化学的方法可以提纯。
纯净物:
(1)概念:只由一种物质组成的物质。
(3)纯净物的分类:纯净物根据物质组成的元素种类,分为两大类:单质和化合物。
纯净物和氧化物的区别:
| 纯净物 | 混合物 | |
| 概念 | 宏观:由一种物质组成的物质 微观:由同种分子构成(对于由分子构成的物质而言) |
宏观:由两种或多种物质组成的物质 微观:由不同种分子构成(对于由分子构成的物质而言) |
| 区别 | 由同种物质组成(对于由分子构成的物质,是由同种分子构成的),组成是固定的 | 由不同种物质组成(对于由分子构成的物质. 是由不同种分子构成的),组成是不固定的 |
| 特点 | ①具有固定的组成 ②具有一定的性质 ③有专门的化学符号 |
①没有固定的组成和性质 ②各成分保持各自的性质 ③没有专门的化学符号 |
| 分离方法 | 组成固定,不需分离;若需将化合物分成几种单质,则必须通过化学方法才能实现 | 物理方法: 筛选 过滤 蒸馏 |
| 实例 | 氧气,二氧化碳,高锰酸钾 | 空气,粗盐,蔗糖水 |
| 联系 | 纯净物是相对而言的,自然界中绝对纯净的物质是不存在的,通常的纯净物是指含杂质很少的具有高纯度的物质。两者间的关系为 | |
对纯净物和混合物概念的理解:
(1)混合物概念:混合物可以看作是由几种纯净物混合而成的,混合物的形成过程中发生的是物理变化。由于混合物的组成一般不固定,所以往往不能用化学式表示。
(2)纯净物概念:纯净物只由一种物质组成,有固定的组成.可以用化学式表示。
常考的纯净物与混合物:
(1)混合物:石油、煤、天然气、洁净的空气、生理盐水、矿泉水、汽水、碘酒、白酒、双氧水、盐酸、合金等都是混合物。
(2)纯净物:水银、烧碱、纯碱、胆矾、液态氧、液态氮、蒸馏水(纯水)、干冰、冰水共存物、金刚石、石墨、生石灰、熟石灰、氯化钠、氧化铁等都是纯净物:
物质的分类示意图:
合金的概念:
合金是在金属中加热熔合某些金属或非金属形成的具有金属特性的物质。
①合金可以是金属与金属或金属与非金属的混合物,不一定全部由金属组成。
②合金具有金属特性,如导电性、导热性、延展性等。
③合金是几种成分熔合在一起形成的,发生的是物理变化,不是化学变化;合金不是几种成分简单地混合而成的。
④合金中各成分仍保持自己的性质。
合金与组成它们的金属的性质比较:
金属熔合了其他金属或非金属后,不仅组成上发生了变化,其内部结构也发生了改变,从而引起性质的变化。因而合金比纯金属具有更广泛的用途。 纯金属与合金性质的比较:
①合金一般比其组分金属的颜色更鲜艳。
②合金的硬度一般应工组成它的金属。
③合金的熔点一般低于成它的金属。
④合金的抗腐蚀能力一般强工组成它的金属。
⑤合金的导电性、导热隆能一般差于组成它的金属。
生铁和钢的比较:
知识点拨:
①生铁和熟铁:生铁是指含碳债在 2%一4.3%之间的铁合金,熟铁是用生铁精炼而成的较纯的铁,含碳量低于0.02%。
②生铁与铸铁:铸铁是生铁中的一种,是指可用来铸造的生铁,通常指球墨铸铁。
③碳素钢的性能与含碳址有关,含碳量越高,硬度越大,但韧性越差;含碳量越低,韧性越好,但硬度越小。
④纯铁与日常生活中铁的颜色差异日常生活,我们接触的铁一般不是纯铁,而是一些铁的氧化物或含铁的混合物,故我们常见的铁的颜色是黑色的,但它并不是纯铁的颜色,纯铁的颜色是银白色的。
应用广泛的合金:
(1)铁合金:铁合金包括生铁和钢,生铁和钢的主要成分是铁,钢与生铁的各种性能不同,主要是由于二者的含碳量不同。
生铁与钢的种类
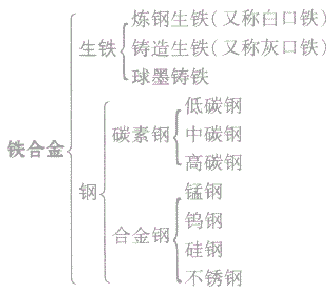
(2)生铁与钢:
生铁的含碳量为2%—4.3%
钢的含碳量为0.03%—2%
(3)钛和钛合金:钛和钛合金被认为是21世纪的重要金属材料。
①性质:优异的耐腐蚀性,对海水、空气和若干腐蚀介质都稳定,可塑性好,强度大,密度小,又称亲生物金属;
②用途:喷气发动机、飞机.机身、人造卫星外壳、火箭壳体、医学补形、人造骨、海水淡化设备、海轮和舰艇的外壳等。
合金是在金属中加热熔合某些金属或非金属形成的具有金属特性的物质。
①合金可以是金属与金属或金属与非金属的混合物,不一定全部由金属组成。
②合金具有金属特性,如导电性、导热性、延展性等。
③合金是几种成分熔合在一起形成的,发生的是物理变化,不是化学变化;合金不是几种成分简单地混合而成的。
④合金中各成分仍保持自己的性质。
合金与组成它们的金属的性质比较:
金属熔合了其他金属或非金属后,不仅组成上发生了变化,其内部结构也发生了改变,从而引起性质的变化。因而合金比纯金属具有更广泛的用途。 纯金属与合金性质的比较:
①合金一般比其组分金属的颜色更鲜艳。
②合金的硬度一般应工组成它的金属。
③合金的熔点一般低于成它的金属。
④合金的抗腐蚀能力一般强工组成它的金属。
⑤合金的导电性、导热隆能一般差于组成它的金属。
生铁和钢的比较:
| 含碳量 | 2%—4% | 0.03%—2% |
| 其他元素 | Si、Mn、S、P(少量) | Si、Mn等 |
| 机械性能 | 硬而脆,无韧性 | 坚硬,韧性大,塑性好,有弹性 |
| 机械加工性质 | 可铸不可锻 | 可铸,可锻,可压延 |
| 分类 | 白口铁,灰口铁,球墨铸铁 | 碳素钢,合金钢 |
知识点拨:
①生铁和熟铁:生铁是指含碳债在 2%一4.3%之间的铁合金,熟铁是用生铁精炼而成的较纯的铁,含碳量低于0.02%。
②生铁与铸铁:铸铁是生铁中的一种,是指可用来铸造的生铁,通常指球墨铸铁。
③碳素钢的性能与含碳址有关,含碳量越高,硬度越大,但韧性越差;含碳量越低,韧性越好,但硬度越小。
④纯铁与日常生活中铁的颜色差异日常生活,我们接触的铁一般不是纯铁,而是一些铁的氧化物或含铁的混合物,故我们常见的铁的颜色是黑色的,但它并不是纯铁的颜色,纯铁的颜色是银白色的。
应用广泛的合金:
(1)铁合金:铁合金包括生铁和钢,生铁和钢的主要成分是铁,钢与生铁的各种性能不同,主要是由于二者的含碳量不同。
生铁与钢的种类

(2)生铁与钢:
生铁的含碳量为2%—4.3%
钢的含碳量为0.03%—2%
(3)钛和钛合金:钛和钛合金被认为是21世纪的重要金属材料。
①性质:优异的耐腐蚀性,对海水、空气和若干腐蚀介质都稳定,可塑性好,强度大,密度小,又称亲生物金属;
②用途:喷气发动机、飞机.机身、人造卫星外壳、火箭壳体、医学补形、人造骨、海水淡化设备、海轮和舰艇的外壳等。
金属冶炼:
金属冶炼是把金属从化合态变为游离态的过程
矿石
①工业上能用来提炼金属的矿物叫做矿石。
②常见的矿石赤铁矿(Fe2O3)、黄铁矿(FeS2)、褐铁矿(Fe2O3·xH2O)、水铝石(Al2O3·H2O)、菱铁矿(主要成分是FeCO3)、磁铁矿(Fe3O4)、方铅矿(PbS)、孔雀石 [Cu2(OH)2CO3]、赤铜矿(Cu2O)、铝土矿(主要成分是Al2O3)、黄铜矿(主要成分是CuFeS2)、辉铜矿(主要成分是Cu2S)。
铁的冶炼
①原理:把铁矿石冶炼成铁是一个复杂的过程,其主要的反应原理是:
在高温下,利用还原剂一氧化碳把铁从铁矿石里还原出来,其反应的化学方程式是: Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
②炼铁的原料及作用:
铁矿石:提供原料
焦炭:提供能量,产生还原剂
石灰石:将矿石中的二氧化硅转变为炉渣。
③设备:高炉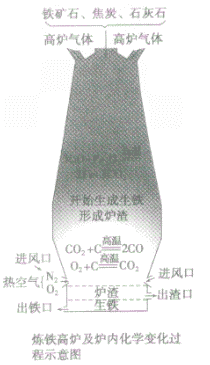
④高炉内有关反应:
a.产生CO提供能量:C+O2 CO2;CO2+C
CO2;CO2+C 2CO
2CO
b.在高温下用CO将Fe从Fe2O3中还原出来:3CO+ Fe2O3 2Fe + 3CO2
2Fe + 3CO2
c.用石灰石将矿石中的SiO2转变为炉渣除去。
CaCO3 CaO+CO2↑,CaO+SiO2
CaO+CO2↑,CaO+SiO2 CaSiO3
CaSiO3
⑤产品:生铁
炼铁高炉中出铁口低于出渣口的原因:
炼铁高炉中出铁口与出渣口的高低取决于铁水和炉渣的密度〔铁水的密度大于炉渣的密度)。
金属的冶炼方法:
①热分解法(适用于Hg,Ag不活泼的金属的冶炼,加热使其氧化物分解) 如:
2HgO=Hg+O2↑
②热还原法(适用于金属活动性顺序表中,Zn- Cu金属的冶炼)
a.用H2作还原剂(优点:制得金属纯度高,污染小) 如:Fe3O4+4H2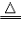 3Fe+4H2O
3Fe+4H2O
b.用焦炭、一氧化碳作还原剂(易混入杂质,污染大气,适合工业化大规模生产) 如:
炼铁的反应方程式为Fe2O3+3CO 2Fe +3CO2
2Fe +3CO2
炼锌的反应万程式为2ZnO+C 2Zn+CO2↑
2Zn+CO2↑
c.用Al作还原剂(铝热剂用来焊接铁轨) 如:
8Al+3Fe3O4 9Fe+4Al2O3
9Fe+4Al2O3
d.电解法(适用于活泼金属Na,Mg等的冶炼) 如:
2NaCl(熔融) 2Na+Cl2↑ ;MgCl2(熔融)
2Na+Cl2↑ ;MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑
e.湿法冶金(从溶液中通过化学反应来获取金属) 如:
Fe+CuSO4==Cu+FeSO4
金属冶炼是把金属从化合态变为游离态的过程
矿石
①工业上能用来提炼金属的矿物叫做矿石。
②常见的矿石赤铁矿(Fe2O3)、黄铁矿(FeS2)、褐铁矿(Fe2O3·xH2O)、水铝石(Al2O3·H2O)、菱铁矿(主要成分是FeCO3)、磁铁矿(Fe3O4)、方铅矿(PbS)、孔雀石 [Cu2(OH)2CO3]、赤铜矿(Cu2O)、铝土矿(主要成分是Al2O3)、黄铜矿(主要成分是CuFeS2)、辉铜矿(主要成分是Cu2S)。
铁的冶炼
①原理:把铁矿石冶炼成铁是一个复杂的过程,其主要的反应原理是:
在高温下,利用还原剂一氧化碳把铁从铁矿石里还原出来,其反应的化学方程式是: Fe2O3+3CO
 2Fe+3CO2
2Fe+3CO2 ②炼铁的原料及作用:
铁矿石:提供原料
焦炭:提供能量,产生还原剂
石灰石:将矿石中的二氧化硅转变为炉渣。
③设备:高炉

④高炉内有关反应:
a.产生CO提供能量:C+O2
 CO2;CO2+C
CO2;CO2+C 2CO
2COb.在高温下用CO将Fe从Fe2O3中还原出来:3CO+ Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 c.用石灰石将矿石中的SiO2转变为炉渣除去。
CaCO3
 CaO+CO2↑,CaO+SiO2
CaO+CO2↑,CaO+SiO2 CaSiO3
CaSiO3⑤产品:生铁
炼铁高炉中出铁口低于出渣口的原因:
炼铁高炉中出铁口与出渣口的高低取决于铁水和炉渣的密度〔铁水的密度大于炉渣的密度)。
金属的冶炼方法:
①热分解法(适用于Hg,Ag不活泼的金属的冶炼,加热使其氧化物分解) 如:
2HgO=Hg+O2↑
②热还原法(适用于金属活动性顺序表中,Zn- Cu金属的冶炼)
a.用H2作还原剂(优点:制得金属纯度高,污染小) 如:Fe3O4+4H2
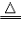 3Fe+4H2O
3Fe+4H2O b.用焦炭、一氧化碳作还原剂(易混入杂质,污染大气,适合工业化大规模生产) 如:
炼铁的反应方程式为Fe2O3+3CO
 2Fe +3CO2
2Fe +3CO2炼锌的反应万程式为2ZnO+C
 2Zn+CO2↑
2Zn+CO2↑ c.用Al作还原剂(铝热剂用来焊接铁轨) 如:
8Al+3Fe3O4
 9Fe+4Al2O3
9Fe+4Al2O3 d.电解法(适用于活泼金属Na,Mg等的冶炼) 如:
2NaCl(熔融)
 2Na+Cl2↑ ;MgCl2(熔融)
2Na+Cl2↑ ;MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑ e.湿法冶金(从溶液中通过化学反应来获取金属) 如:
Fe+CuSO4==Cu+FeSO4
金属锈蚀:
金属材料受周围介质的作用而损坏,称为金属腐蚀。金属的锈蚀是最常见的腐蚀形态。腐蚀时,在金属的界面上发生了化学或电化学多相反应,使金属转入氧化(离子)状态。这会显著降低金属材料的强度、塑性、韧性等力学性能,破坏金属构件的几何形状,增加零件间的磨损,恶化电学和光学等物理性能,缩短设备的使用寿命,甚至造成火灾、爆炸等灾难性事故。
铁生锈条件的探究
易错点:
①探究铁生锈的条件时采用经煮沸后迅速冷却的蒸馏水,目的是赶走水中溶解的氧气;再加上植物油用来隔绝空气。
②环境中的某些物质会加快铁的锈蚀,如与酸、食盐溶液等接触的铁制品比钢铁生锈更快。
③铁生锈的过程。实际上是铁与空气中的氧气、水蒸气等发生化学反应的过程(缓慢氧化)。反应过程相当复杂,最终生成物铁锈是一种混合物。铁锈(主要成分是Fe2O3·H2O)为红色,疏松多孔,不能阻碍内层的铁继续与氧气、水等反应,因此铁制品可以全部锈蚀。
④许多金属都易生“锈”,但“锈”的结构不同,成分不同。铜在潮湿的空气中也能生“锈”,铜锈即铜绿,其主要成分为碱式碳酸铜[Cu2(OH)2CO3],是铜与水、氧气、二氧化碳共同作用的产物。
金属制品的防锈原理及方法:
(1)防锈原理根据铁的锈蚀条件不难推断出防止铁生锈的方法是使铁制品隔绝空气或隔绝水。
(2)防锈方法:
①保持铁制品表面洁净和干燥,如菜刀不用时擦干放置。
②在钢铁表面覆盖保护膜、如车、船表而涂油漆。
③在钢铁表而镀一层其他金属,如水龙头表面镀铬、镀锌。
④用化学方法使钢铁表面形成致密的保护膜,如烤蓝。
⑤改善金属的结构,如将钢铁制成不锈钢
(3)除锈方法
物理方法:用砂纸打磨,用刀刮。
化学方法:用酸清洗(酸不能过量),发生的反应为:Fe2O3+6HCl==2FeCl3+3H2O或Fe2O3+3H2SO4==Fe2(SO4)3+3H2O。
金属材料受周围介质的作用而损坏,称为金属腐蚀。金属的锈蚀是最常见的腐蚀形态。腐蚀时,在金属的界面上发生了化学或电化学多相反应,使金属转入氧化(离子)状态。这会显著降低金属材料的强度、塑性、韧性等力学性能,破坏金属构件的几何形状,增加零件间的磨损,恶化电学和光学等物理性能,缩短设备的使用寿命,甚至造成火灾、爆炸等灾难性事故。
铁生锈条件的探究
| 实验装置 | 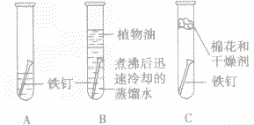 |
| 实验现象 | 几天后观察A试管中铁钉生锈,在水面附近锈蚀 严重,B,C试管中的铁钉没有生锈 |
| 实验分析 | A试管中的铁钉同时跟水、空气(或氧气)接触而生锈; B试管中的铁钉只与水接触不生锈; C 试管中的铁钉只与干燥的空气(或氧气)接触不生锈 |
| 实验结论 | 铁生锈的条件是与水、空气(或氧气)同时接触 |
易错点:
①探究铁生锈的条件时采用经煮沸后迅速冷却的蒸馏水,目的是赶走水中溶解的氧气;再加上植物油用来隔绝空气。
②环境中的某些物质会加快铁的锈蚀,如与酸、食盐溶液等接触的铁制品比钢铁生锈更快。
③铁生锈的过程。实际上是铁与空气中的氧气、水蒸气等发生化学反应的过程(缓慢氧化)。反应过程相当复杂,最终生成物铁锈是一种混合物。铁锈(主要成分是Fe2O3·H2O)为红色,疏松多孔,不能阻碍内层的铁继续与氧气、水等反应,因此铁制品可以全部锈蚀。
④许多金属都易生“锈”,但“锈”的结构不同,成分不同。铜在潮湿的空气中也能生“锈”,铜锈即铜绿,其主要成分为碱式碳酸铜[Cu2(OH)2CO3],是铜与水、氧气、二氧化碳共同作用的产物。
金属制品的防锈原理及方法:
(1)防锈原理根据铁的锈蚀条件不难推断出防止铁生锈的方法是使铁制品隔绝空气或隔绝水。
(2)防锈方法:
①保持铁制品表面洁净和干燥,如菜刀不用时擦干放置。
②在钢铁表面覆盖保护膜、如车、船表而涂油漆。
③在钢铁表而镀一层其他金属,如水龙头表面镀铬、镀锌。
④用化学方法使钢铁表面形成致密的保护膜,如烤蓝。
⑤改善金属的结构,如将钢铁制成不锈钢
(3)除锈方法
物理方法:用砂纸打磨,用刀刮。
化学方法:用酸清洗(酸不能过量),发生的反应为:Fe2O3+6HCl==2FeCl3+3H2O或Fe2O3+3H2SO4==Fe2(SO4)3+3H2O。
发现相似题
与“钢铁在生产、生活中有广泛的用途.建造上海世博会的中国馆--“...”考查相似的试题有:
- 对已学过的知识进行梳理、归纳,是中学生应该掌握的学习方法.请你完成下列对化学反应的归纳:(举例写出文字表达式)化学反...
- A、B、C、D、E、F、G、H、I都是初中化学学过的物质.其中E、F、H均为黑色固体,B为紫红色固体,D为混合物.他们之间有如图的...
- “瘦肉精” 学名盐酸克伦特罗, 化学式为C12H18Cl2N2O,食用含有“瘦肉精”的肉会对人体产生危害。下列关于瘦肉精说法正确的是A....
- 生产、生活中处处有化学。(1)液态二氧化碳灭火器主要用于扑救贵重设备、档案资料等初起火灾。在加压时将液态二氧化碳压缩在...
- 在我国推广使用“清洁燃料”的过程中,2005年5月16日上海交通大学宣布:我国首台使用二甲醚为燃料的城市客车问世,这将有效地解...
- 通过九年级一年的化学学习,我们初步认识了“酸”和“碱”,请回答下列问题:(1)常见的酸有盐酸、硫酸等,在不同的酸溶液中都含...
- 芳芳和丽丽把“探究鱼鳔内气体体积和成分”列为家庭小实验,她们通过查阅有关资料获悉:鳔内氧气约占25%,其余主要是二氧化碳和...
- 象征着“和平、友谊、进步”的奥运会五环旗同学们都非常熟悉.如图“五环旗”中的每一环表示一种物质,相连环物质间能发生反应,...
- 冶炼铁的原料有:______、______、______.其反应原理是在高温下,用______作还原剂将铁从铁的氧化物中还原出来.以赤铁矿为...
- 用相应的化学符号填空:①2个氟原子______;②3个氮分子______;③2个铜离子______;④硫酸铁中铁的化合价______;⑤人体内含量最...