本试题 “常温下,下列物质的水溶液,其pH小于7的是( ) A.Na2CO3 B.NH3•H2O C.NaCl D.NH4Cl” 主要考查您对强电解质电离(氯化钠、硫酸氢钠等物质的电离)
盐类水解的定义
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 强电解质电离(氯化钠、硫酸氢钠等物质的电离)
- 盐类水解的定义
强电解质电离:
强电解质在溶液中完全电离,且符号为“=”,如NaCl=Na++Cl-、NaHSO4==Na++H++SO42-
强电解质在溶液中完全电离,且符号为“=”,如NaCl=Na++Cl-、NaHSO4==Na++H++SO42-
酸与碱反应的几种情况:
1.等体积、等物质的量浓度的酸 混合
混合 
2.等体积的酸 混合
混合 
3.若酸 等体积混合溶液呈中性
等体积混合溶液呈中性 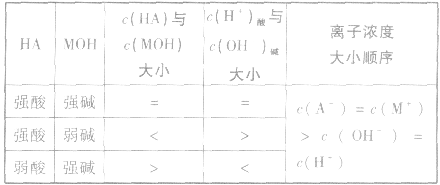
4.强酸溶液(pH=a)与强碱溶液(pH=b)完全中和时的体积比

盐类水解:
1.定义:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类水解。
2.实质:生成弱电解质,使水的电离平衡被破坏而建立新的平衡。
3.条件:盐中必须有弱酸根离子或弱碱阳离子,盐溶于水。
4.特点:可逆性,写水解离子方程式时要用“ ” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
5.规律:有弱才水解,无弱不水解。谁弱谁水解,谁强显谁性。越弱越水解,都弱都水解。例如:25℃时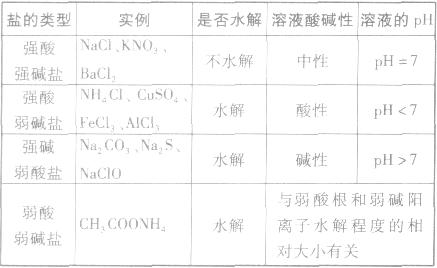
四种重要的动态平衡的比较:
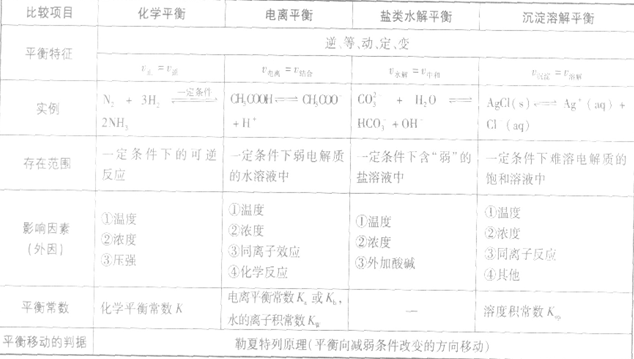
发现相似题
与“常温下,下列物质的水溶液,其pH小于7的是( ) A.Na2CO3 B...”考查相似的试题有:
- 在一定条件下,下列反应属于水解反应的是( ) A.CO+H2O⇌CO2+H2 B.H2S+H2O⇌H3O++HS- C.H2O+H2O⇌H3O++OH- D.NH4++H2O⇌NH3•...
- 已知H2B在溶液中的电离方程式:H2B = H++HB-, HB-H++B2-。下列叙述一定正确的是A. Na2B溶液存在:c (Na+) =" 2c" (HB-) + 2c...
- (20分) Ⅰ.(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,该反应的化学方程式为 ;生成0.1molK2FeO4转移的电子...
- 100℃时,下列各溶液中,离子的物质的量浓度关系正确的是:A.pH=11的氨水中:c(OH-)=3.0mol·L-1B.呈中性的醋酸和醋酸钠...
- 常温下,下列溶液中的微粒浓度关系正确的是( )A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)B.pH=8.3的...
- 下列溶液中各微粒浓度关系判定不正确的是A.10mL 0.2 mol·L-1的氨水与l0mL 0.1 mol·L-1的盐酸充分反应混合后的溶液中,存在c(N...
- 下列推断合理的是A.在常温下,Na2SiO3+H2O+CO2= Na2CO3+H2SiO3↓,说明H2CO3酸性强于H2SiO3;在高温下,,说明H2SiO3酸性强于...
- 0.1 mol·L-1的下列物质的水溶液中,氢离子浓度最大的是A.NH3·H2OB.NH4ClC.HClD.HCOOH
- A.CaCl2B.CH3COONaC.NH3D.K2S
- 下列根据反应原理设计的应用,不正确的是( )A.CO32-+ H2OHCO3-+ OH-热的纯碱溶液清洗油污B.Al3++ 3H2OAl(OH)3+ 3H+明...