本试题 “下列有关实验操作、发生的现象、解释或结论都正确的是( ) 选项 实验操作发生现象 解释或结论 A 向NaCl和KI的混合溶液中,逐滴加入AgNO3溶液 溶液中先产生白...” 主要考查您对氯气
沉淀溶解平衡
原电池原理
电解池原理
气体的检验
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氯气
- 沉淀溶解平衡
- 原电池原理
- 电解池原理
- 气体的检验
氯气:
①化学式:Cl2
②氯元素在周期表中的位置:第三周期ⅦA族
③氯原子的电子式: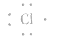
④氯的原子结构示意图: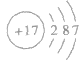
⑤氯原子的外围电子排布式:
⑥化学键类型:非极性共价键
⑦氯分子的电子式:
⑧氯分子的结构式:
氯气的物理性质和化学性质:
(1)物理性质:黄绿色,有刺激性气味,有毒,密度比空气大,能溶于水(1:2)。
(2)化学性质:氯气(Cl2)是双原子分子,原子的最外层有七个电子,是典型的非金属元素,单质是强氧化剂。
①氯气与金属反应: 2Na+Cl2
 2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2
2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2 2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2
2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2 CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。
CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。 ②与非金属的反应 H2+Cl2
 2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2
2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2 2HCl(发生爆炸) 2P+3Cl2
2HCl(发生爆炸) 2P+3Cl2 2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。
2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。 ③与碱反应 Cl2+2NaOH==NaCl+NaClO+H2O 2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
④与某些还原性物质反应:Cl2+2FeCl2===2FeCl3 Cl2+SO2+2H2O==2HCl+H2SO4
⑤有机反应(参与有机反应的取代和加成反应)
CH4+Cl2→CH3Cl+HCl
CH3Cl+Cl2→CH2Cl2+HCl
CH2Cl2+Cl2→CHCl3+HCl
CHCl3+Cl2→CCl4+HCl
Cl2+CH2=CH2→CH2Cl-CH2Cl(加成反应)
⑥与水反应 Cl2+H2O
 HCl+HClO
HCl+HClO 1、定义:在一定条件下,当难容电解质的溶解速率与溶液中的有关离子重新生成沉淀的速率相等,此时溶液中存在的溶解和沉淀间的动态平衡,称为沉淀溶解平衡。
例如:
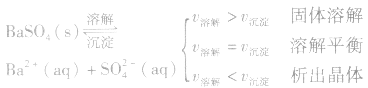
2、沉淀溶解平衡的特征:
(1)逆:沉淀溶解平衡是可逆过程。
(2)等:
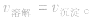
(3)动:动态平衡,溶解的速率和沉淀的速率相等且不为零。
(4)定:达到平衡时,溶液中各离子的浓度保持不变,
(5)变:当外界条件改变时,溶解平衡将发生移动,达到新的平衡。
3、沉淀溶解平衡的影响因素
(1)内因:难溶电解质本身的性质。
(2)外因
a.浓度:加水稀释,沉淀溶解平衡向溶解的方向移动,但
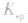 不变。
不变。 b.温度:多数难溶电解质溶于水是吸热的,所以升高温度,沉淀溶解平衡向溶解的方向移动,同时
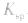 变大。
变大。 c.同离子效应:向沉淀溶解平衡体系中,加入含原体系中某离子的物质,平衡向沉淀生成的方向移动,但
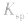 不变。
不变。 d.其他:向沉淀溶解平衡体系中,加入可与体系巾某些离子反应生成更难溶的物质或气体的物质,平衡向溶解的方向移动,
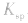 不变。
不变。沉淀溶解平衡的应用:
1.沉淀的生成
(1)意义:在涉及无机制备、提纯工艺的生产、科研、废水处理等领域中,常利用生成沉淀来达到分离或除去某些离子的目的。
(2)方法
a.调节pH法:如工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7~8,可使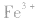 转变为
转变为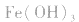 沉淀而除去。
沉淀而除去。 
b.加沉淀剂法:如以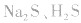 等作沉淀剂,使某些金属离子如
等作沉淀剂,使某些金属离子如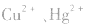 等生成极难溶的硫化物
等生成极难溶的硫化物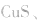
 等沉淀,也是分离、除杂常用的方法。
等沉淀,也是分离、除杂常用的方法。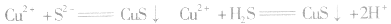
说明:化学上通常认为残留在溶液中的离子浓度小于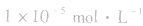 时即沉淀完全。
时即沉淀完全。
2.沉淀的溶解
(1)意义:在实际工作中,常常会遇到需要使难溶物质溶解的问题、根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去沉淀溶解平衡体系中的相应离子,使 平衡就会向沉淀溶解的方向移动,使沉淀溶解。
平衡就会向沉淀溶解的方向移动,使沉淀溶解。
(2)方法
a.生成弱电解质:加入适当的物质,使其与沉淀溶解平衡体系中的某离子反应生成弱电解质。如向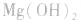 沉淀中加入
沉淀中加入 溶液,
溶液,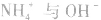 结合生成
结合生成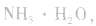 使
使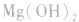 的溶解平衡向右移动。
的溶解平衡向右移动。
b.生成配合物:加入适当的物质,使其与沉淀反应生成配合物。
如:

c.氧化还原法:加入适当的物质,使其与沉淀发生氧化还原反应而使沉淀溶解。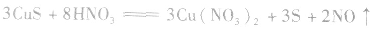
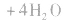
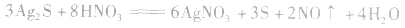
d.沉淀转化溶解法:本法是将难溶物转化为能用上述三种方法之一溶解的沉淀,然后再溶解:
如向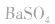 中加入饱和
中加入饱和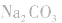 溶液使
溶液使 转化为
转化为 再将
再将 溶于盐酸。
溶于盐酸。
3.沉淀的转化
(1)实质:沉淀转化的实质就是沉淀溶解平衡的移动。一般来说,溶解度小的沉淀转化成溶解度更小的沉淀容易实现。 例如
(2)沉淀转化在工业上的应用在工业废水处理的过程中,用FeS等难溶物作沉淀剂除去废水中的重金属离子.
固体物质的溶解度:
绝对不溶解的物质是不存在的,任何难溶物质的溶解度都不为零。不同的固体物质在水中的溶解度差别很大,可将物质进行如下分类: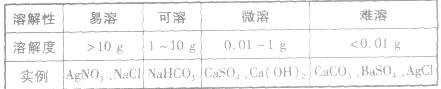
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例

(1)装置图:

(2)原理图:

3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
原电池中的电荷流动:
在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子 (带负电荷)向负极移动。这样形成了电荷持续定向流动,电性趋向平衡的闭合电路。
(1)电解:使电流通过电解质溶液且在阴、阳极两极引起氧化还原反应的过程叫电解。
(2)装置:电解池(电解槽)
(3)特点:将电能转化为化学能。
形成条件:①与电源相连的两个电极,②电解质溶液或熔融电解质,③形成闭合回路
(4)阴离子放电顺序:S2->I->Br->Cl->OH->SO42->NO3->F- 阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
(5)电解时溶液pH值的变化规律电解质溶液在电解过程中,有时溶液pH值会发生变化。判断电解质溶液的pH值变化,有时可以从电解产物上去看。
①若电解时阴极上产生H2(消耗H+),阳极上无O2产生,电解后溶液pH值增大;
②若阴极上无H2,阳极上产生O2,则电解后溶液pH值减小;
③若阴极上有H2,阳极上有O2,且(相当于电解水),则有三种情况:
a如果原溶液为中性溶液,则电解后pH值不变;
b如果原溶液是酸溶液,则pH值变小;
c如果原溶液为碱溶液,则pH值变大;
④若阴极上无H2,阳极上无O2产生,电解后溶液的pH可能也会发生变化。如电解CuCl2溶液(CuCl2溶液由于Cu2+水解显酸性),一旦CuCl2全部电解完,pH值会变大,成中性溶液。
(6)电解反应类型:从参加反应的物质来分电解反应可分成五类:
①H2O型:实质是电解水。如电解硝酸钠、氢氧化钠、硫酸等溶液。
②溶质型:溶质所电离出来的离子发生氧化还原,如电解氯化铜、溴化氢等溶液。
③硫酸铜溶液型:电解产物是金属、氧气与酸。如电解硫酸铜溶液生成单质铜、氧气和硫酸,电解硝酸银溶液时生成单质银、氧气和硝酸。
④氯化钠溶液型:电解产物是非金属单质、氢气与碱。如电解氯化钠溶液时生成氯气、氢气和氢氧化钠,电解溴化钾溶液时生成溴单质、氢气和氢氧化钾。
⑤电镀型:镀层金属作阳极,阳极反应是:M-ne-=Mn+,镀件作阴极,阴极反应是:Mn++ne-=M。(电解精炼与电镀,实质上是相同的)
原电池、电解池、电镀池的比较:


(1)观察法:对于特殊颜色的气体如Cl2(黄绿色)、NO2(红棕色)、碘蒸气(紫红)可据此辨之。
(2)溶解法:根据溶于水的现象不同区分,如NO2和溴蒸气均为红棕色,但溶于水后NO2形成无色溶液;溴形成橙色溶液。
(3)褪色法:SO2和CO2可用品红溶液区分。
(4)氧化法:被空气氧化看变化,如NO的检验。
(5)试纸法:如石蕊试纸、醋酸铅试纸。
(6)星火发:适用于有助燃性或可燃性的气体检验,如O2使带火星木条复燃;CH4和C2H2的检验可点燃看现象;CH4、CO、H2则可根据其燃烧产物来判断。
常见气体的检验:
(1)H2:无色、无味、可燃;①不纯点燃发出爆鸣声;②点燃纯H2,火焰呈淡色,火焰上方罩一干燥烧杯,烧杯壁上有水珠生成:2H2+O2
 2H2O
2H2O (2)O2:无色无味、能使余烬木条复燃;
(3)Cl2:黄绿色刺激性气体有毒;①使湿润淀粉碘化钾试纸变蓝:Cl2+2KI=2KCl+I2 I2遇淀粉变蓝;②使湿润蓝色石蕊试纸先变红后变白:Cl2+H2O=HCl+HClO HClO强氧化性漂白作用;
(4)CO2:无色无味无毒;①使燃着木条熄灭;②通入澄清石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O
(5)CO:无色、无味、剧毒;点燃火焰呈蓝色,火焰上方罩一沾有石灰水液滴的烧杯,液滴变浑浊:
2CO+O2
 2CO2 CO2+Ca(OH)2=CaCO3↓+H2O
2CO2 CO2+Ca(OH)2=CaCO3↓+H2O (6)NO2: 红棕色气体有刺激性气味、有毒,溶于水、水溶液呈酸性,能使紫色石蕊试液变红:3NO2+H2O=2HNO3+NO
(7)NO:无色气体有毒;在空气中立即变为红棕色:2NO+O2=2NO2
(8)N2: 无色无味无毒;能使燃着木条熄灭。
(9)SO2:无色有刺激性气味、有毒;①通入品红溶液,品红褪色加热又恢复颜色;②使澄清石灰水变浑浊:
SO2+Ca(OH)2=CaSO3+H2O;
③使酸性高锰酸钾溶液褪色:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
(10)HCl:无色刺激性气味;①能使湿润蓝色石蕊试纸变红:HCl=H++Cl-; ②用蘸浓氨水玻璃棒靠近冒白烟:NH3+HCl=NH4Cl;③气体通入HNO3酸化的AgNO3溶液,有白色沉淀生成:HCl+AgNO3=AgCl↓+HNO3 (AgCl不溶于HNO3)
(11)H2S:无色臭鸡蛋气味有毒;遇Pb(NO3)2 、(CH3COO)2Pb、CuSO4溶液均产生黑色沉淀:Pb2++H2S=PbS↓+2H+;2CH3COO-+Pb2++H2S=PbS↓+2CH3COOH;Cu2++H2S=CuS↓+2H+
(12)NH3:无色刺激性气味;①遇湿润红色石蕊试纸变蓝:NH3+H2O
 NH3?H2O
NH3?H2O NH4++OH-;②用蘸浓盐酸玻璃棒靠近冒白烟:NH3+HCl==NH4Cl
NH4++OH-;②用蘸浓盐酸玻璃棒靠近冒白烟:NH3+HCl==NH4Cl (13)CH4:无色无味、可燃;点燃后火焰呈浅蓝色,火焰上方罩一干燥烧杯,烧杯壁上有水珠罩生成;罩一沾有石灰水液滴的烧杯,液滴变浑浊:CH4+2O2
 CO2+2H2O CO2+Ca(OH)2==CaCO3↓+H2O
CO2+2H2O CO2+Ca(OH)2==CaCO3↓+H2O (14)C2H4: 无色稍有气味;①点燃,火焰明亮(少量黑烟):C2H4+3O2
 2CO2+2H2O ;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH2=CH2+Br2→CH2Br-CH2Br
2CO2+2H2O ;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH2=CH2+Br2→CH2Br-CH2Br (15)C2H2:无色无味;①点燃火焰明亮并伴有大量黑烟:2C2H2+5O2
 4CO2+2H2O;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH≡CH+2Br2→CHBr2-CHBr2
4CO2+2H2O;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH≡CH+2Br2→CHBr2-CHBr2 物质检验的基本原则:
物质检验的“三个原则”,即一看(颜色、状态)、二嗅(气味)、三实验(加试剂)。根据实验时生成物所表现的现象不同,检验离子的方法可归纳为四类:
(1)生成气体,如 的检验;
的检验;
(2)生成沉淀,如 的检验;
的检验;
(3)显现特殊颜色,如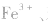 苯酚的检验。
苯酚的检验。
(4)焰色反应:检验金属或金属离子。
与“下列有关实验操作、发生的现象、解释或结论都正确的是( ) ...”考查相似的试题有:
- 如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )ABCD喷洒...
- 下列说法正确的是[ ]A.浓硝酸在光照下变黄,证明硝酸不稳定,且产物有红棕色气体可溶于浓硝酸B.向某溶液中加入氯化钡溶液和...
- (14分)从固体混合物A出发可以发生如下框图所示的一系列变化.G为不溶于稀硝酸的白色固体;溶液H的焰色反应呈紫色(透过蓝色...
- (7分) 喷泉是一种常见的自然现象,产生原因是存在压强差。试根据下图,回答下列问题:(1)在图A的烧瓶中充满干燥气体,胶头...
- pH=3的二元弱酸H2R溶液与V L pH=11的NaOH溶液混合后,混合液的pH=7.下列判断正确的是( )A.溶液的总体积为2VLB.溶液中C(...
- 向饱和澄清石灰水中加入少量CaC2,充分反应后恢复到原来的温度,所得溶液中A.c(Ca2+)、c(OH-)均增大B.c(Ca2+)、c(OH-)...
- 2008年北京奥运会“祥云”火炬用的是环保型燃料--丙烷,悉尼奥运会火炬所用燃料为65%丁烷和35%丙烷,已知丙烷的燃烧热为:2221...
- 以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池...
- 某同学按图所示的装置进行电解实验。下列说法正确的是[ ]A.电解过程中,铜电极上有H2产生B.电解初期,主反应方程式为:Cu+...
- 如下图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O下列说法正确的是[ ]A.甲池是电能转化为化学能的装置,...