本试题 “在乙烯分子中有5个σ 键、1个π键,它们分别是[ ]A.sp2杂化轨道形成σ键、末杂化的2p轨道形成π键B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键C.C-H之间是sp2杂...” 主要考查您对杂化轨道理论(中心原子杂化方式)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 杂化轨道理论(中心原子杂化方式)
杂化轨道理论:
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
分子的构型与杂化类型的关系:
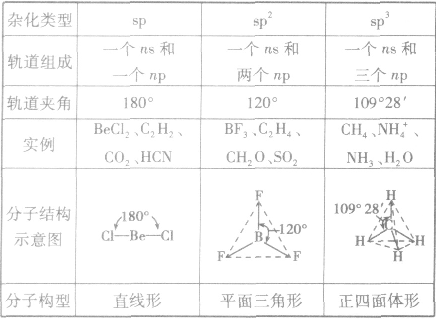
发现相似题
与“在乙烯分子中有5个σ 键、1个π键,它们分别是[ ]A.sp2杂化轨道...”考查相似的试题有:
- 【三选一—选修物质结构与性质】短周期元素X、Y、Z、W原子序数依次增大,已知W与X原子最外层都只有1个s电子,二者电子层数之差...
- 试用杂化轨道理论分析为什么BF3的空间构型是平面三角形,而NF3是三角锥形的?_________________________________________
- 2010年上海世博会场馆,大量的照明材 料或屏幕都使用了发光二极管( LED)。 目前市售LED品片,材质基本以GaAs (砷化镓)、AlG...
- (1)金属钛(22Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,写出Ti元素的基态原子电子排布式为______;(2)日常生...
- 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。 ...
- Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。(1)[Cu(NH3)4]2+中存在的化学键类型有________(填序号)。A.配位键 B.极性...
- 雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得。(1)元素第一电离能:Al________Mg(选填:“...
- 四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y 原子的L层p轨道中有2个电...
- [化学--选修3:物质结构与性质]W、Q、R、X、Y、Z六种元素的原子序数逐渐增大.已知W原子Is轨道上只有一个电子,Q、X原子p轨道...
- A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大。第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原...