本试题 “等量镁铝合金分别与下列4种过量的溶液充分反应,放出氢气最多的是( )A.2mol•L-1H2SO4溶液B.18mol•L-1H2SO4溶液C.6mol•L-1KOH溶液D.3mol•L-1HNO3溶液” 主要考查您对单质铝
镁的单质及其化合物
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 单质铝
- 镁的单质及其化合物
铝的主要性质:
- 物理性质:
铝是银白色,具有金属光泽的固体,硬度较小,具有良好的导电性、导热性和延展性。 - 化学性质:
活泼金属,具有较强的还原性;常温下铝在浓硫酸和浓硝酸中发生钝化;既可以与酸反应又可以与碱反应。
(1)与氧气反应: (纯氧中发出耀眼的白光)
(纯氧中发出耀眼的白光)
(2)与Cl2 、S 、N2反应: (Al2S3在溶液中完全双水解)
(Al2S3在溶液中完全双水解)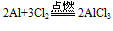
 (AlN与水反应生成Al(OH)3和NH3↑)
(AlN与水反应生成Al(OH)3和NH3↑)
(3)与水反应: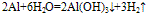
(4)与酸反应: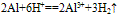
(5)与碱的反应:
(6)铝热反应:2Al+Fe2O3=(高温)=Al2O3+2Fe - 铝的用途
纯铝制作导线,铝合金用于制造飞机、汽车、生活用品等。
铝的特殊性质:
铝既能与酸反应,也能与强碱反应。
铝与酸反应:铝与浓硫酸在常温下发生钝化,2Al+6HCl==2AlCl3+3H2↑
铝与碱反应:2Al+2NaOH+2H2O==2NaAlO2+3H2↑
铝热反应:
铝热法是一种利用铝的还原性获得高熔点金属单质的方法。此种反应被称为铝热反应。
可简单认为是铝与某些金属氧化物(如Fe2O3、Fe3O4、Cr2O3、V2O5等)或非金属氧化物(如SiO2等)在高热条件下发生的反应。
铝热反应常用于冶炼高熔点的金属,并且它是一个放热反应,
其中镁条为引燃剂,氯酸钾为助燃剂。
其装置如下图所示: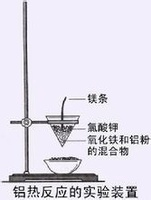
铝热反应配平技巧:
取反应物和生成物中氧化物中两边氧的最小公倍数,即可快速配平,如8Al+3Fe3O4=4Al2O3+9Fe中,可取Fe3O4和Al2O3中氧的最小公倍数12,则Fe3O4前应为3Al2O3前应为4,然后便可得到Al为8,Fe为9。
镁铝的化学性质比较:
| 单质 | 镁 | 铝 |
| 与非金属反应 | 2Mg+O2=(点燃)=2MgO (发出耀眼白光) Mg+Cl2=(点燃)=MgCl2 3Mg+N2=(点燃)=Mg3N2 |
4Al+3O2=(加热)=2Al2O3 2Al+3Cl2=(加热)=2AlCl3 2Al+3S=(加热)=Al2S3 |
| 与沸水反应 | Mg+2H2O=(加热)=Mg(OH)2+H2↑ | 不反应 |
| 与酸反应 | Mg+2H+==Mg2++H2↑ 与稀硝酸反应生成Mg(NO3)2、NOx(或者N2、NH4NO3)、H2O |
2Al+6H+==2Al3++3H2↑ 在冷的浓硝酸或浓硫酸中钝化 |
| 与氧化物反应 | 2Mg+CO2=(点燃)=2MgO+C (剧烈燃烧,生成白色粉末和黑色固体) |
2Al+Fe2O3=(高温)=2Fe+Al2O3(铝热反应) |
| 与盐溶液反应 | Mg+2NH4++2H2O==Mg2++2NH3·H2O+H2↑ Mg+Cu2+==Mg2++Cu |
2Al+3Hg2+=2Al3++3Hg |
| 与强碱反应 | 不反应 | 2Al+2OH-+2H2O==2AlO2-+3H2↑ |
铝热反应配平技巧:
取反应物和生成物中氧化物中两边氧的最小公倍数,即可快速配平,如8Al+3Fe3O4=4Al2O3+9Fe中,可取Fe3O4和Al2O3中氧的最小公倍数12,则Fe3O4前应为3Al2O3前应为4,底下便可得到Al为8,Fe为9。
铝与酸、碱反应的计算技巧:
铝与酸、碱反应的实质都是 ,
, ,所以根据得失电子守恒可知:
,所以根据得失电子守恒可知: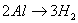 ,利用此关系可以方便地进行有关计算。
,利用此关系可以方便地进行有关计算。
铝与酸或碱溶液反应生成H2的量的计算:
Al是我们中学阶段学习的唯一既与H+反应也与OH-反应的金属,它与酸、碱反应既有相同点,也有不同点。
相同点:Al均被氧化成+3价,所以1molAl不论与H+还是与OH-反应均生成3gH2。
不同点:1molAl与H+反应消耗3molH+,而与OH-反应只消耗1molOH-,所以含有等物质的量的NaOH溶液和HCl溶液分别与足量的铝反应时生成的氢气的物质的量之比为3∶1。

“铝三角”关系:
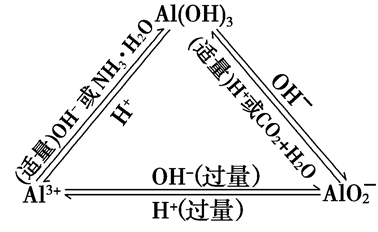
Al3++3OH-===Al(OH)3↓
Al(OH)3+OH-===AlO2-+2H2O
Al3++4OH-===AlO2-+2H2O
AlO2-+2H2O+CO2===Al(OH)3↓+HCO3-
AlO2-+H++H2O===Al(OH)3↓
AlO2-+4H+===Al3++2H2O
钝化:
铝、铁在常温下与浓硫酸发生钝化,钝化不是不反应,而是被氧化成一层致密的氧化物薄膜,恰恰说明金属的活泼性。
镁:
化学式Mg,它是一种银白色的轻质碱土金属,化学性质活泼,能与酸反应生成氢气,具有一定的延展性和热消散性。镁元素在自然界广泛分布,是人体的必需元素之一,原子结构示意图: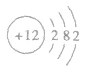 。
。
氧化镁:
化学式MgO是镁的氧化物,一种离子化合物。常温下为一种白色固体。氧化镁以方镁石形式存在于自然界中,是冶镁的原料。
氢氧化镁:
化学式Mg(OH)2,式量58.32。白色无定形粉末。难溶于水,易溶于稀酸和铵盐溶液。饱和水溶液的浓度为1.9毫克/升(18℃),呈碱性。加热到350℃失去水生成氧化镁。用做分析试剂,还用于制药工业。氧化镁跟水反应可得氢氧化镁。
镁及其化合物的物理性质和化学性质:
| 物理性质 | 化学性质 | |
| Mg | 银白色固体,密度1.738g﹒cm3-,熔点645℃,沸点1090℃,导电导热性较好,延展性较好 | ①镁和铝两元素的原子最外层分别有2个和3个电子。在参加化学反应时,容易失去最外层电子成为阳离子,表现还原性。 Mg-2e-==Mg2+ ②镁与非金属反应 O2+2Mg  2MgO 2MgOCl2+Mg  MgCl2 MgCl2 S+Mg  MgS MgS3Mg+N2  Mg3N2 Mg3N2 说明在常温下,镁能与空气里的氧气发生反应,生成一层致密的氧化物薄膜,从而使金属失去光泽。由于这层氧化物薄膜能阻止金属的继续氧化,所以镁有抗腐蚀性。 ③镁与酸反应 2HCl+Mg==MgCl2+H2↑ 2H++Mg==Mg2++H2↑ 镁跟硝酸、浓硫酸反应时,硝酸中的氮元素、硫酸中的硫元素被还原,不生成氢气。 ④镁跟某些氧化物反应 2Mg+CO2  C+2MgO C+2MgO ⑤镁跟水反应 Mg+2H2O  Mg(OH)2+H2↑ Mg(OH)2+H2↑ 说明:镁跟冷水反应非常缓慢. |
| MgO | 白色固体,离子化合物,熔点为3073K,硬度(莫氏)为6.5,难溶于水的固体,熔点很高,是很好的耐火材料 | 典型的碱性氧化物,不能与水反应 |
| Mg(OH)2 | 白色难溶于水的固体,其水溶液中c(OH-)很小,可以使酚酞溶液变成浅红色 Mg(OH)2(s)  Mg2+(aq)+2OH-(aq) Mg2+(aq)+2OH-(aq) |
①可与酸反应生成盐和水,如Mg(OH)2+2HCl==MgCl2+2H2O ②热稳定性差,受热容易分解 Mg(OH)2  MgO+H2O MgO+H2O |
工业制备镁:
电解熔融状态的氯化镁制取镁
阳极反应:2Cl--2e-==Cl2↑
阴极反应:Mg2++2e-==Mg
总反应:MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑
Mg2++2Cl-==Mg+Cl2↑
说明氧化镁比氯化镁熔点高,为了降低能耗,工业电解制取镁采用的原料是氯化镁而不是氧化镁。
氧化镁的应用:
氧化镁可用于染料,油漆,玻璃,化学试剂,医药,食品添加剂等方面,工业上利用MgO熔点高的特点,制造耐火材料。
与“等量镁铝合金分别与下列4种过量的溶液充分反应,放出氢气最多...”考查相似的试题有:
- 某氧化物不溶于水,溶于NaOH溶液中,生成易溶于水的化合物,向稀盐酸中滴入该溶液,有白色沉淀生成,则原氧化物是( )A.Al(...
- 铁及其化合物在日常生活中应用广泛,请回答下列问题:(1)Fe(NO3)3·9H2O易溶于水,微溶于硝酸,主要用作催化剂和媒染剂,...
- 我国计划用8年时间对5·12四川汶川大地震进行灾后重建,重建需要大量钢材和金属合金材料。下列说法正确的是( )A.铁和钢材的主...
- (8分)把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示。求:(1)合金中...
- 某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如...
- 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是 [ ]abcA.AlAlCl3Al(OH)3B.HNO3NONO2C.SiSiO2H2SiO3D...
- 将5.1g镁铝合金,投入到500mL2.0mol/L的盐酸中,金属完全溶解,再加入4.0mol/L的NaOH溶液,若要生成的沉淀最多,则NaOH溶液...
- 下列对于合金性质的叙述不正确的是( )A.合金的熔点低于它的任何一种成分金属的熔点B.合金的硬度一般比各成分金属的硬度都...
- (14分)实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:(1)制备MgAl2O4过程中,高温焙烧时发...
- 有关合金的说法错误的是 ( )A.硬度增大B.熔点降低C.导电性增强D.有金属光泽