构成物质的微粒:
构成物质的粒子有分子、原子、离子
分子:能够独立存在并保持物质化学性质的一种微粒。
原子:化学变化中的最小粒子。
离子:带电荷的原子或原子团。
原子的构成:
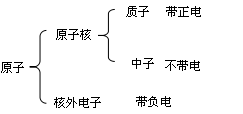
(1)在原子中核电荷数=质子数=核外电子数决定元素种类质子数(核电荷数)
(2)原子的质量主要集中在原子核上
(3)三决定:质子数决定元素种类
最外层电子数决定化学性质
原子核决定原子的质量
(4)相对原子质量≈质子数+中子数
说明:最外层电子数相同其化学性质不一定都相同(Mg,He最外层电子数为2);最外层电子数不同其化学性质有可能相似(He,Ne均为稳定结构)
原子、分子、离子的区别与联系:
区别:
离子是原子或原子团由于得失电子而形成的带电微粒。
原子是化学变化中的最小微粒。
分子是物质中保持原物质的一切化学性质、能够独立存在的最小微粒。
联系:
分子是由原子组成的。在化学变化中,分子可再分,原子不可再分。分子是独立存在而保持物质化学性质的最小粒子。
原子、分子、离子的表示方法:
原子通常用 表示,分子用化学式表示,离子用
表示,分子用化学式表示,离子用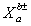 表示。
表示。
定义:
元素的性质随原子序数的递增而呈现周期性变化的规律叫元素周期律。
实质:
元素性质随原子序数递增呈现周期性变化是元素原子的核外电子排布周期性变化的必然结果。
元素周期表中主族元素性质递变规律:

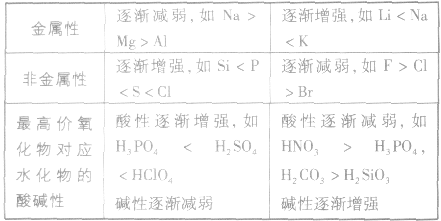
金属性强弱的判断依据:
1.单质跟水或酸反应置换出氢的难易程度(或反应的剧烈程度):反应越容易,说明其金属性越强。
2.最高价氧化物对应水化物的碱性强弱:碱性越强,说明其金属性越强,反之则越弱。
3.金属间的置换反应:依据氧化还原反应的规律,金属甲能从金属乙的盐溶液里置换出乙,说明甲的金属性比乙强。
4.金属活动性顺序按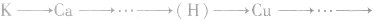 Au顺序,金属性逐渐减弱。
Au顺序,金属性逐渐减弱。
5.元素周期表中,同周期元素从左至右金属性逐渐减弱;同主族元素从上至下金属性逐渐增强。
6.原电池中的正负极:一般情况下,活泼金属作负极。
7.金属阳离子氧化性的强弱:阳离子的氧化性越强.对应金属的金属性就越弱。
非金属性强弱的判断依据:
1.同周期元素,从左到右,随核电荷数的增加,非金属性增强;同主族元素,从上到下,随着陔电荷数的增加,非金属性减弱。
2.最高价氧化物对应水化物的酸性强弱:酸性越强,其元素的非金属性也越强,反之则越弱。
3.气态氢化物的稳定性:稳定性越强,非金属性越强。
4.单质跟氢气化合的难易程度:越易与H2反应,说明其非金属性越强。
5.与盐溶液之间的置换反应:非金属元素甲的单质能从非金属乙的盐溶液中置换出乙,说明甲的非金属性比乙强。如 ,说明溴的非金属性比碘强。
,说明溴的非金属性比碘强。
6.相互化合后的价态:如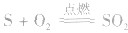 ,说明O 的非金属性强于S。
,说明O 的非金属性强于S。
7.其他:如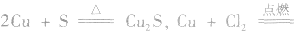 CuCl2,所以C1的非金属性强于S。
CuCl2,所以C1的非金属性强于S。
微粒半径大小的比较方法:
1.同周期元素的微粒
同周期元素的原子或最高价阳离子半径随核电荷数增大而减小(稀有气体元素除外),如半径:Na>Mg >Al,Na+>Mg2+‘>Al3+。
2.同主族元素的微粒
同主族元素的原子或离子半径随核电荷数增大而增大,如半径: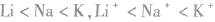
3.电子层结构相同的微粒电子层结构相同(核外电子排布相同)的微粒半径随核电荷数的增加而减小,如半径: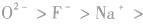
 (上一周期元素形成的阴离子与下一周期元素形成的最高价阳离子有此规律)。
(上一周期元素形成的阴离子与下一周期元素形成的最高价阳离子有此规律)。
4.同种元素形成的微粒同种元素原子形成的微粒半径大小为:阳离子< 中性原子<阴离子;价态越高的微粒半径越小,如半径: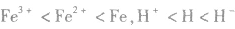 。
。
5.核外电子数和核电荷数都不同的微粒可通过一种参照物进行比较,如比较 的半径大小,可找出与A13+电子数相同,与S同主族的氧元素的阴离子
的半径大小,可找出与A13+电子数相同,与S同主族的氧元素的阴离子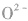 进行比较,半径:
进行比较,半径: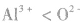 ,且
,且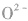
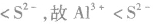
元素周期表中的几项重要规律相等规律:
| 规律 |
内容 |
| 相等规律 |
①周期数:电子层数
②主族元素原子的最外层电子数=价电子数=主族序数=最高正化合价(F、 0除外)
③最低负价绝对值=8一主族序数(限 ⅣA族~ⅦA族非金属元素) |
| “位、构、性”规律 |
|
| 递变规律 |
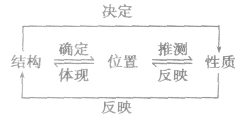 |
|
同周期从左到右,元素的金属性逐渐减弱,非金属性逐渐增强同主族从上到下,元素的金属性逐渐增强,非金属性逐渐减弱 |
| 奇偶规律 |
在同一主族内,族序数和原子序数、核内质子数、核电荷数、核外电子数、最外层电子数(价电子数)、离子的电荷数、元素的主要正负化合价数等,若一个是偶数,其他的都是偶数,若一个是奇数,其他的都是奇数 |
| 相同电子层结构的规律 |
稀有气体元素的原子与同周期非金属元素的阴离子以及下一周期主族金属元素的阳离子具有相同的电子层结构 |
| 序差规律 |
①同主族相邻元素的原子序数之差与主族序数有关。IA~ⅡA族元素相差原子序数较小的元素所在周期包含的元素种数。ⅢA族~O族元素相差原子序数较大的元素所在周期包含的元素种数。如Na和K的原子序数相差8 (第三周期含8种元素),Cl和Br的原子序数相差18(第四周期含18种元素)
②同周期主族元素(长周期)的原子序数差:两元素分布在过渡元素同侧时,原子序数差=族序数差;两元素分布在过渡元素两侧时,第四或第五周期元素原子序数差=族序数差+10(如第四周期的Ca和Ca相差11),第六、七周期元素原子序数差=族序数差+24(如ⅡA 族的Ba和ⅢA族的Tl相差25) |
| 对角线相似规律 |
周期表中位于对角线位置的元素性质相似,尤以“和Mg、Be和Al最为典型 |