本试题 “关于化学能与热能的叙述,正确的是[ ]A.1mol酸与碱恰好中和时所放出的热量叫中和热B.化学反应中的能量变化,主要是由化学键的变化引起的C.需要加热才能发...” 主要考查您对吸热反应、放热反应
中和热
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 吸热反应、放热反应
- 中和热
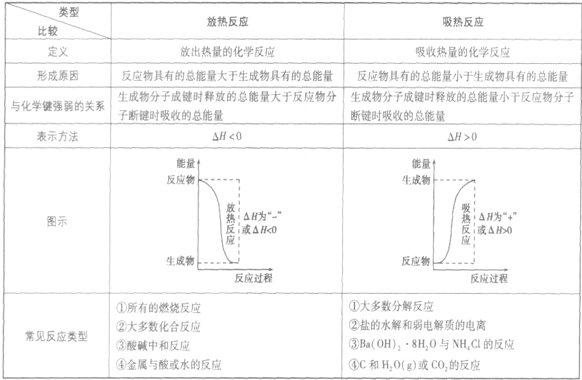
吸热反应:
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:

中和热:
在稀溶液中,酸和碱发生中和反应生成1molH2O时的反应热。中和热的表示方法: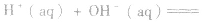
在稀溶液中,酸和碱发生中和反应生成1molH2O时的反应热。中和热的表示方法:
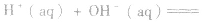
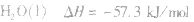
影响中和热测定的因素:
中和反应巾放出的热量为(m1+m1)·c·(t1-t2),其巾溶液的比热容c是已知的,对于给定的反应物的质量m1和m2也是定值,这样求算出的中和热是否接近 57.3kl·mol-1,取决于溶液温度的变化。
在整个实验过程中应把好两关:①隔热关。如:小烧杯周围的泡沫塑料要填满;盖板上两孔只要正好使温度计和环形玻璃搅拌棒通过即可;倒人NaOH溶液要迅速等,尽可能减少实验过程中热量的散失。②准确关。如:配制溶液的浓度要准;NaOH溶液要新制,因为久置的NaOH溶液可能变质导致浓度不准;量取液体体积时读数要准;对溶液温度要读到最高点。
注意事项:
(1)这里的溶液一般要求是稀溶液,这是因为浓酸溶液和浓碱溶液相互稀释时会放出热量
(2)强酸与强碱的反应实质是H+和OH-反应(即与酸、碱的种类无关),通过多次实验测定,1molH+和1molOH-反应生成lmol H2O(l)时,放出的热量为 57.3kJ
(3)中和热是以生成1molH2O为基准的,因此表示中和热的热化学方程式中,水的化学计量数为1,酸、碱的化学计量数可以为分数
发现相似题
与“关于化学能与热能的叙述,正确的是[ ]A.1mol酸与碱恰好中和...”考查相似的试题有:
- 下列反应中生成物总能量高于反应物总能量的有( )A.乙醇燃烧B.KClO3分解制氧气C.铝片与盐酸反应D.氧化钙溶于水
- 下列图像分别表示有关反应的反应过程与能量变化的关系: 据此判断下列说法中正确的是 [ ]A.石墨转变为金刚石是吸热反应B.白...
- 在25℃、101kPa下,1g乙醇完全燃烧生成CO2和液态水时放热29.72kJ,下列热化学方程式正确的是( )A.CH3CH2OH(l)+3O2(g)=2...
- 已知在298K时的热化学反应方程式:(3分)C(s,石墨)+O2(g)=CO2(g); △H1=-393.5kJ/mol,2CO(g)+O2(g)=2CO2(g); △H2=-566.0kJ...
- 盖斯定律在生产和科学研究中有很重要的意义。已知3.6g碳在6.4g氧气中燃烧,至反应物耗尽,放出了X kJ热量。已知碳完全燃烧的...
- 在100 g炭不完全燃烧所得气体中CO和CO2的体积比为1∶2。已知:C(s)+1/2O2(g)=CO(g) ΔH1=-110.35 kJ/molCO(g)+1/2...
- 下列叙述正确的是A.吸热反应一定需要加热才能发生,放热反应不需要从外界吸收任何能量就能发生B.伴有能量变化的物质变化都...
- 强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l) △H=-57.3KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的...
- 最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1molN-N吸收193kJ热量...
- 已知:2CO(g) + O2(g) = 2CO2(g) ΔH="-566" kJ·mol-1;N2(g) + O2(g) =2NO(g) ΔH="+180" kJ·mol-1.则2CO(g) +2NO(g) = N2(g)...