本试题 “D、E为中学化学常见的金属单质,F是一种黑色晶体。E与C的浓溶液在常温作用无明显现象,加热时则有大量无色气体产生,同时生成H。在一定条件下C、D间能发生反...” 主要考查您对无机推断
四氧化三铁
单质铜
(浓)硫酸
电解池电极反应式的书写
离子的检验
电化学有关的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 无机推断
- 四氧化三铁
- 单质铜
- (浓)硫酸
- 电解池电极反应式的书写
- 离子的检验
- 电化学有关的计算
无机推断的解题题眼:
1.题眼一:
常见气体单质气体:H2、O2、N2、Cl2(黄绿色)、F2(淡黄绿色)
气态氢化物:NH3(无色有刺激性气味,易液化,极易溶于水,能使湿润的红色石蕊试纸变蓝,遇到HCl形成白烟)
HCl(无色有刺激性气味,极易溶于水,能使湿润的蓝色石蕊试纸变红,在空气中形成白雾,遇到NH3形成白烟)
H2S(无色有臭鸡蛋气味,蛋白质腐败的产物,能溶于水,能使湿润的醋酸铅试纸变黑)
非金属气态氧化物:CO、CO2(直线型非极性分子)、NO(遇到空气变红棕色)、NO2(红棕色,加压、降温会转变成无色N2O4)、SO2(无色、有刺激性气味、能使品红溶液褪色) [固态氧化物]:SO3(无色晶体、易挥发)、P2O5(白色固体、易吸湿,常用作干燥剂)、SiO2(不溶于水、不溶于普通酸的高熔点固体,但溶于氢氟酸和强碱溶液)
气态卤代烃:一氯甲烷(CH3Cl)、氯乙烯(CH2=CHCl)气态醛:甲醛(HCHO)
2.题眼二:
气体溶解性归纳难溶于水的:H2、N2、CO、NO、CH4、C2H4;
微溶于水的:O2、C2H2;
能溶于水的:Cl2(1:1)、H2S(1:2.6)、SO2(1:40);
极易溶于水的:NH3(1:700)、HCl(1:500)、HF、HBr、HI。
3.题眼三:
常见液态物质无机物:液溴Br2、水(H2O)、过氧化氢(H2O2)、二硫化碳(CS2)、三氯化磷(PCl3)
有机物:一般5个碳原子以上的低级烃;除一氯甲烷、氯乙烯之外的低级卤代烃;低级醇;除甲醛之外的低级醛;低级羧酸;低级酯。
4.题眼四:
常见物质的颜色
①红色:Fe(SCN)3(红色溶液); Cu2O(红色固体);Fe2O3(红棕色固体); 液溴(深红棕色);Fe(OH)3(红褐色固体);Cu(紫红色固体);溴蒸气、NO2(红棕色)
②紫色:Fe3+与苯酚反应产物(紫色);I2(有金属光泽紫黑色固体)KMnO4固体(紫黑色);MnO4-(紫红色溶液) 钾的焰色反应(紫色) I2蒸气、I2在非极性溶剂中(紫色)
③橙色:溴水(橙色) K2Cr2O7溶液(橙色)
④黄色:AgI(黄色固体);AgBr(淡黄色固体); FeS2(黄色固体);Na2O2(淡黄色固体);S(黄色固体);I2的水溶液(黄色);Na的焰色反应(黄色);工业浓盐酸(黄色)(含有Fe3+);Fe3+的水溶液(黄色);久置的浓硝酸(黄色)(溶有分解生成的NO2);浓硝酸粘到皮肤上(天然蛋白质)(显黄色);
⑤绿色:Cu2(OH)2CO3(绿色固体);Fe2+的水溶液(浅绿色);FeSO4?7H2O(绿矾);Cl2、氯水(黄绿色);F2(淡黄绿色); CuCl2的浓溶液(蓝绿色);
⑥棕色:FeCl3固体(棕黄色);CuCl2固体(棕色)
⑦蓝色:Cu(OH)2、CuSO4?5H2O、Cu2+在水溶液中(蓝色);淀粉遇I2变蓝色; Cu(OH)2溶于多羟基化合物(如甘油、葡萄糖等)的水溶液中(绛蓝色);
⑧黑色:FeO;Fe3O4;FeS;CuO;CuS;Cu2S;MnO2;C粉;Ag2S;Ag2O;PbS; AgCl、AgBr、AgI、AgNO3光照分解均变黑;绝大多数金属在粉末状态时呈黑色或灰黑色。
⑨白色:常见白色固体物质如下(呈白色或无色的固体、晶体很多):AgCl;Ag2CO3;Ag2SO4;Ag2SO3;BaSO4;BaSO3;BaCO3;CaCO3;MgO;Mg(OH)2;MgCO3;Fe(OH)2;AgOH;PCl5;SO3;三溴苯酚;铵盐(白色固体或无色晶体); Fe(OH)2沉淀在空气中的现象:白色→(迅速)灰绿色→(最终)红褐色
5.题眼五:
根据框图中同一元素化合价的变化为主线,即A→B→C→……型归纳
C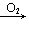 CO
CO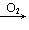 CO2;H2S
CO2;H2S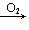 S
S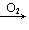 SO2
SO2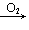 SO3(H2SO4); NH3(N2)
SO3(H2SO4); NH3(N2) NO
NO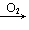 NO2→HNO3; Na
NO2→HNO3; Na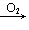 Na2O
Na2O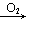 Na2O2; Fe→Fe2+→Fe(OH)2
Na2O2; Fe→Fe2+→Fe(OH)2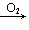 Fe(OH)3;Fe→Fe2+→Fe3+;
Fe(OH)3;Fe→Fe2+→Fe3+;
CH2=CH2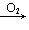 CH3CHO
CH3CHO CH3COOH;CH3CH2OH
CH3COOH;CH3CH2OH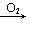 CH3CHO
CH3CHO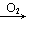 CH3COOH
CH3COOH
6.题眼六:
根据化学反应形式
(1)根据置换反应“单质+化合物=新的单质+新的化合物” 进行推理
㈠金属置换金属
铝热反应:需高温条件才能引发反应的发生,通常用来冶炼一些高熔点金属。如:2Al+Fe2O3 Al2O3+2Fe; 8Al+3Fe3O4
Al2O3+2Fe; 8Al+3Fe3O4 4Al2O3+9Fe
4Al2O3+9Fe
㈡.金属置换非金属
①金属与水反应置换出H2 2Na+2H2O==2Na++2OH-+H2↑ (非常活泼的金属在常温下与H2O反应) 3Fe+4H2O Fe3O4+4H2↑
Fe3O4+4H2↑
②金属与非氧化性酸(或氧化物)反应 2Al+6H+==2Al3++3H2↑;2Mg+CO2 2MgO+C
2MgO+C
㈢.非金属置换非金属
①非金属单质作氧化剂的如:2F2+2H2O==4HF+O2;2FeBr2+3Cl2==2FeCl3+2Br2;X2+H2S==2H++2X-+S↓(X2=Cl2、Br2、I2);2H2S+O2(不足) 2S+2H2O (H2S在空气中不完全燃烧) 2H2S+O2==2S↓+2H2O(氢硫酸久置于空气中变质)
2S+2H2O (H2S在空气中不完全燃烧) 2H2S+O2==2S↓+2H2O(氢硫酸久置于空气中变质)
②非金属单质作还原剂的如:C+H2O CO+H2 (工业上生产水煤气的反应) Si+4HF==SiF4(易挥发)+2H2↑
CO+H2 (工业上生产水煤气的反应) Si+4HF==SiF4(易挥发)+2H2↑
㈣.非金属置换金属
如:2CuO+C 2Cu+CO2↑
2Cu+CO2↑
①根据反应“化合物+化合物=单质+化合物”进行推理,常见的该类型反应有:
2Na2O2+2H2O==4NaOH+O2↑
2Na2O2+2CO2==2Na2CO3+O2
2H2S+SO2==3S↓+2H2O
KClO3+6HCl(浓) KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②根据反应“一种物质三种物质”进行推理,常见该类型的反应有:
Cu2(OH)2CO3 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
NH4HCO3 NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
(NH4)2CO3 2NH3↑+CO2↑+H2O
2NH3↑+CO2↑+H2O
NH4HSO3 NH3↑+SO2↑+H2O
NH3↑+SO2↑+H2O
③根据反应“化合物+单质==化合物+化合物+……”,常见该类型的反应有:
Na2SO3+Cl2+H2O==Na2SO4+2HCl
Na2SO3+Br2+H2O==Na2SO4+2HBr
C+4HNO3(浓)==CO2↑+4NO2↑+2H2O
Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
7.题眼七:
根据常见反应的特征现象。
(1)两种物质反应既有沉淀又有气体生成的
①双水解:主要指Al3+、Fe3+与CO32-、HCO3-等之间的双水解
②Ba(OH)2和(NH4)2SO4生成氨气和硫酸钡沉淀
(2)遇水能放出气体的
①Li、Na、K、Ca、Ba、Mg(△)、Fe(高温)[氢后面的金属不跟水反应]
②Na2O2、NaH、CaC2、Al2S3、Mg3N2
③加碱能产生气体的:Al、Si、NH4+
④加酸有沉淀生成的:如SiO32-、AlO2-、S2O32-、C6H5O-(常温下)
⑤有“电解”条件的,通常联想到下列代表物:
a.电解电解质型:不活泼金属的无氧酸盐如CuCl2(aq)
b.放氧生酸型:不活泼金属的含氧酸盐如CuSO4(aq)
c.放氢生碱型:活泼金属的无氧酸盐如NaCl(aq)
d.电解熔融离子化合物:如Al2O3(l)、NaCl(l)
无机推断题的突破方法:
解决无机框图推断题的一般流程是:
整体浏览、寻找突破;
由点到面、广泛联系;
大胆假设、验证确认;
明确要求、规范解答 。
解题的关键是仔细审题,依据物质的特征来寻找突破口,顺藤摸瓜,进而完成全部未知物的推断。常用的突破方法主要有以下几种。
1.依据元素或物质的特征数据突破
常用的有:
(1)在地壳中含量最多的元素是氧;
(2)在地壳中含量最多的金属元素是铝;
(3)组成化合物种类最多的元素是碳;
(4)相对分子质量最小的单质是氢气;
(5)日常生活中应用最广泛的金属是铁。
2.依据物质的特性突破
常用的有:
(1)使淀粉变蓝的是I2;
(2)能使铁、铝钝化的是冷的浓硫酸或浓硝酸;
(3)能与SiO2反应而能雕刻玻璃的是氢氟酸;
(4)能使品红溶液褪色,褪色后的溶液受热后恢复红色的是二氧化硫;
(5)遇SCN-溶液变红色的是Fe3+;
(6)在放电的条件下与氧气化合生成NO的是氮气;
(7)能与水剧烈反应生成氧气的气体是F2;
(8)具有磁性的黑色固体是Fe3O4;
(9)红棕色粉末是Fe2O3;
(10)黄绿色气体是Cl2,红褐色沉淀是Fe(OH)3,能与水反应放出气体的淡黄色粉末是Na2O2。
3.依据物质的特殊用途突破
常用的有:
(1)可作呼吸面具和潜水艇中的供氧剂的是Na2O2;
(2)可用于杀菌、消毒、漂白的物质主要有Cl2、ClO2、NaClO和漂白粉等;
(3)可用作半导体材料、太阳能电池的是晶体硅;
(4)用于制造光导纤维的是SiO2;
(5)可用于治疗胃酸过多的物质是NaHCO3、Al(OH)3等;
(6)可用于制造发酵粉的是NaHCO3;
(7)可用作钡餐的是BaSO4;
(8)可用于焊接钢轨、冶炼难熔金属的是铝热剂;
(9)可用作感光材料的是AgBr;
(10)可用作腐蚀印刷电路板的是FeCl3溶液。
4.依据特殊现象突破
常用的有:
(1)燃烧时产生苍白色火焰的是氢气在氯气中燃烧;
(2)灼烧时火焰呈黄色的是含钠元素的物质;
(3)灼烧时火焰呈紫色(透过蓝色钴玻璃)的是含钾元素的物质;
(4)在空气中迅速由无色变红棕色的气体是NO;
(5)白色沉淀迅速变为灰绿色,最后变为红褐色的是Fe(OH)2转化为Fe(OH)3;
(6)能使湿润的红色石蕊试纸变蓝色的气体是NH3;
(7)使澄清石灰水先变浑浊后变澄清的是CO2、SO2;
(8)加入NaOH溶液先产生白色沉淀后沉淀溶解的溶液中含有Al3+。
5.根据限定条件和解题经验突破
常用的有:
(1)“常见金属”往往是铁或铝;
(2)“常见气体单质”往往是H2、N2、O2、Cl2;
(3)“常用的溶剂”往往是H2O;
(4)“常温常压下为液态”的往往是H2O;
(5)“能与过量HNO3反应”则意味着某元素有变价;
(6)“与浓酸反应”的物质往往是铜、碳、MnO2等;
(7)“电解”生成三种物质的往往为NaCl溶液或CuSO4溶液或AgNO3溶液;“电解”生成两种物质的往往是电解水型的溶液,生成的两种物质为氢气和氧气。熔融电解往往是电解Al2O3、NaCl或MgCl2。
无机物间的特殊转化关系:


二、三角型转化
1.铁三角: 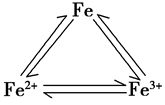
2.铝三角: 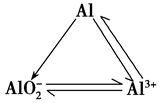
3.氯三角: 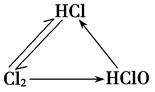
4.硅三角: 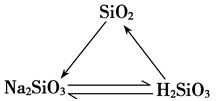
三、交叉型转化关系
1.硫及其重要化合物间的转化 :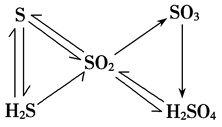
2.氮及其重要化合物间的转化 :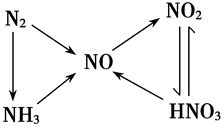
3.钠及其重要化合物间的转化 :



四氧化三铁:
又称磁性氧化铁,具有磁性的黑色晶体,不溶于水,具有优良的导电性。
四氧化三铁的性质:
(1)色态:具有磁性的黑色晶体
(2)别名:磁性氧化铁、氧化铁黑、磁铁、磁石、吸铁石、偏铁酸亚铁
(3)矿物:磁铁矿
(4)溶解性:不溶于水,与酸反应生成+2、+3铁盐
(5)稳定性:稳定
(6)还原性:在高温下,易氧化成三氧化二铁。4Fe3O4+O2 6Fe2O3
6Fe2O3
(7)氧化性:在高温下可与还原剂H2、CO、Al、C等反应。 


铁的氧化物:
| 化学式 | FeO | Fe2O3 | Fe3O4 |
| 俗称 | —— | 铁红 | 磁性氧化铁 |
| 色态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 铁的价态 | +2 | +3 | +2、+3 |
| 水溶性 | 不溶 | 不溶 | 不溶 |
| 与酸反应 | FeO+2H+==Fe2++H2O | Fe2O3+6H+==2Fe3++3H2O | Fe3O4+8H+==Fe2++2Fe3++4H2O |
| 用途 | 玻璃色料 | 油漆、颜料 | 做颜料和抛光剂 |
| 氧化性 | 高温时都能与C、CO、H2反应,被还原生成Fe单质 | ||
铜元素:
在元素周期表中的位置:铜的原子序数29,位于周期表中第四周期,第IB族。
(1)物理性质:有金属光泽,紫红色固体,密度较大,导电导热性能很好,具有很好的延展性,铜属于重金属、有色金属、常见金属,不能被磁铁吸引。
(2)化学性质: 铜常见的化合价为+1价和+2价
①在加热条件下,铜可与多种非金属单质反应。一般来说,遇到氧化性较弱的非金属,铜显较低化合价;遇到氧化性较强的非金属,铜显较高化合价。例如:与强氧化剂反应(如Cl2 Br2等)生成+2价铜的化合物。如:
Cu+Cl2 CuCl2 2Cu+O2
CuCl2 2Cu+O2 2CuO
2CuO
②铜与酸反应:铜只能被氧化性酸中的中心元素氧化。例如: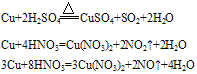
③铜与盐溶液反应:
Cu+2AgCl CuCl2+2Ag
CuCl2+2Ag
铜与铁的对比:
从金属活性顺序表:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au可知,金属铁的金属活性比铜强,所以单质Fe可以从Cu的溶液中还原出单质来,例如: Fe+CuCl2 FeCl2+Cu
FeCl2+Cu
即Fe的还原性强于Cu
铜与浓硫酸和稀硫酸的反应:
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
2Cu+O2+2H2SO4(稀) 2CuSO4+2H2O
2CuSO4+2H2O
注意:从金属活性顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au 可知,铜不能与稀硫酸发生反应,但是在有氧气和加热的条件下可以反应
铜与铜的化合物之间的转换图: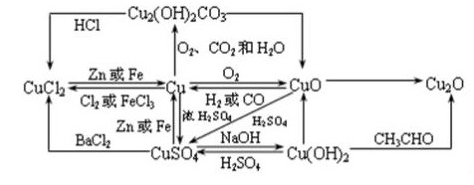
铜的制备和精炼:
(1)工业炼铜法:CuO+CO Cu+CO2
Cu+CO2
(2)湿法炼铜:Fe+CuSO4 FeSO4+Cu
FeSO4+Cu
(3)高温炼铜:工业上用高温冶炼黄铜矿的方法获得铜(粗铜):
2CuFeS2+4O2 Cu2S+3SO2+2FeO(炉渣)
Cu2S+3SO2+2FeO(炉渣)
2Cu2S+3O2 2Cu2O+2SO2
2Cu2O+2SO2
2Cu2O+Cu2S 6Cu+SO2↑
6Cu+SO2↑
备注:粗铜中铜的的含量为99.5%-99.7%,主要含有Ag、Zn、Au等杂质,粗铜通过电解精炼可得到纯度达99.95%-99.98%的铜,原理为用粗铜作阳极,失去电子变为Cu2+,用纯铜棒作阴极即可得精铜。
硫酸:
硫酸的分子式:H2SO4;结构式: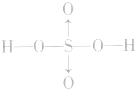 ,H2SO4中硫元素为+6价,处于最 0 高价,具有氧化性,但只有浓H2SO4表现出强氧化性,而稀硫酸、硫酸盐巾的硫元素通常不表现氧化性。
,H2SO4中硫元素为+6价,处于最 0 高价,具有氧化性,但只有浓H2SO4表现出强氧化性,而稀硫酸、硫酸盐巾的硫元素通常不表现氧化性。
硫酸的物理性质和化学性质:
1.硫酸的物理性质
纯硫酸是无色、黏稠的油状液体,密度大,沸点高,是一种难挥发的强酸,易溶于水,能以任意比与水互溶.浓硫酸溶于水时放出大量的热。常见浓硫酸的质量分数为98.3%,其密度为 1.84g·cm-3,沸点为338℃,物质的量浓度为18.4mol·L-1.H2SO4的浓度越大,密度越大,若将30%的H2SO4溶液与10%的H2SO4溶液等体积混合,所得溶液的质量分数大于20%。
2.稀硫酸的化学性质
稀硫酸具有酸的通性。
(1)与指示剂作用:能使紫色石蕊试液变红。
(2)与碱发生中和反应
(3)与碱性氧化物或碱性气体反应 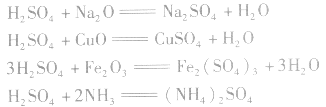
(4)与活泼金属发生置换反应 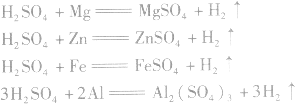
(5)与某些盐溶液反应 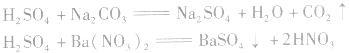
4.浓硫酸的特性
(1)吸水性将一瓶浓硫酸敞口放置在空气中,其质量将增加,密度将减小,浓度降低,体积变大。这是因为浓硫酸具有吸水性,实验室里常利用浓硫酸作干燥剂。
浓硫酸不仅可以吸收空气中的水,还可吸收混在气体中的水蒸气、混在固体中的湿存水、结晶水合物中的部分结晶水。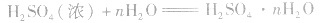 。
。
浓H2SO4中的H2SO4分子可强烈地吸收游离的水分子形成一系列的硫酸水合物: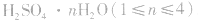 。这些水合物很稳定,所以浓H2SO4可作某些不与其反应的气体、固体的干燥剂,同时不能暴露在空气中。能够用浓H2SO4干燥的气体有
。这些水合物很稳定,所以浓H2SO4可作某些不与其反应的气体、固体的干燥剂,同时不能暴露在空气中。能够用浓H2SO4干燥的气体有 、
、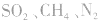 等酸性或中性气体,而具有还原性的气体
等酸性或中性气体,而具有还原性的气体 和碱性气体NH3则不能用浓H2SO4干燥。另外在酯化反应中,如
和碱性气体NH3则不能用浓H2SO4干燥。另外在酯化反应中,如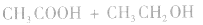
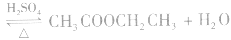 中,浓H2SO4作催化剂和吸水剂。
中,浓H2SO4作催化剂和吸水剂。
(2)脱水性指浓H2SO4将有机物里的氧、氧元素按原子个数比2:1脱去生成水的性质。浓H2SO4从有机物中脱下来的是氢、氧元素的原子,不是水,脱下来的氢、氧元素的原子按2:1的比例结合成H2O;对于分子中所含氢、氧原子个数比为2:l的有机物(如蔗糖、纤维素等),浓H2SO4可使其炭化变黑,如: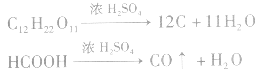
(3)强氧化性常温下,Fe、Al遇浓H2SO4会发生钝化。但热的浓 H2SO4能氧化大多数金属(除金、铂外)、某些非金属单质及一些还原性化合物。如: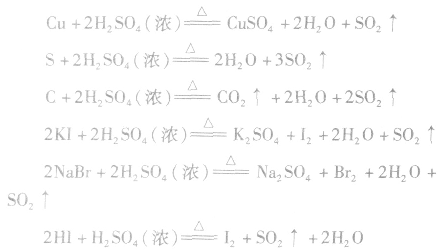
在这些氧化还原反应中,浓硫酸的还原产物一般为SO2。
浓、稀硫酸的比较与鉴别:
1.比较
稀硫酸—弱氧化性—可与活泼金属反应,生成H2—氧化性由H+体现。
浓硫酸——强氧化性——加热时可与绝大多数金属和某些非金属反应,通常生成SO2——氧化性由 体现。
体现。
2.鉴别
从浓H2SO4和稀H2SO4性质的差异人手,可知鉴别浓H2SO4和稀H2SO4的方法有多种。
方法一:取少量蒸馏水,向其中加入少量试样硫酸,如能放出大量热则为浓H2SO4,反之则为稀H2SO4。
方法二:观察状态,浓H2SO4呈黏稠状,而稀H2SO4为黏稠度较小的溶液。
方法三:用手掂掂分量,因为浓H2SO4的密度较大 (1.84g·cm-3,相同体积的浓H2SO4和稀H2SO4,浓H2SO4的质量比稀H2SO4大很多。
方法四:取少量试样,向其中投入铁片,若产生气体,则为稀H2SO4, ;若无明显现象(钝化),则为浓H2SO4。
;若无明显现象(钝化),则为浓H2SO4。
方法五:用玻璃棒蘸取试样在纸上写字,立即变黑 (浓H2SO4的脱水性)者为浓H2SO4,另一种为稀H2SO4。
方法六:取少量试样,分别投入一小块铜片,稍加热发生反应的(有气泡产生)为浓H2SO4。(浓H2SO4的强氧化性),无现象的是稀H2SO4.
硫酸的用途及使用:
(1)用途硫酸是化学工业最黄要的产品之一,它的用途极广(如下图)。
①利用其酸性可制磷肥、氮肥,可除锈,可制实用价值较高的硫酸盐等。
②利用其吸水性,在实验室浓H2SO4常用作干燥剂。
③利用其脱水性,浓H2SO4常作精炼石油的脱水剂、有机反应的脱水剂等。
④利用浓H2SO4的高沸点和难挥发性,常用于制取各种挥发性酸。
⑤浓H2SO4常作有机反应的催化剂。
(2)浓硫酸的安全使用
①浓H2SO4的稀释稀释浓硫酸时应特别注意:将浓硫酸沿器壁慢慢地注入水中,并不断搅拌,使产生的热量迅速地扩散出去。切不可把水倒人浓硫酸里。两种液体混合时,要把密度大的加到密度小的液体中,如浓H2SO4、浓HNO3-混合酸的配制方法是把浓H2SO4沿器壁慢慢地注入浓HNO3中。
②万一不小心将浓硫酸溅到皮肤上、衣服上或桌面上,应分别怎样处理?
皮肤上:用干布迅速拭去,再用大量水冲洗,最后涂上3%~5%的碳酸氢钠溶液。
衣服上:用大量水冲洗。
桌面上:大量时,用适量。NaHCO3,溶液冲洗,后用水冲洗,再用抹布擦干;少量时用抹布擦即可。
1.根据装置书写电极反应式
(1)根据电源确定阴、阳两极→确定阳极是否是活性电极→据电极类型及电解质溶液中阴、阳离子的放电顺序写出电极反应式。
(2)在确保阴、阳两极转移电子数目相同的条件下,将两极电极反应式合并即得总反应式。
2.由氧化还原反应方程式书写电极反应式
(1)找出发生氧化反应和还原反应的物质→确定两极名称和生成物→利用电子守恒分别写出两极反应式。
(2)若写出一极反应式,而另一极反应式不好写,可用总反应式减去已写出的电极反应式,即得另一电极反应式。
(1)焰色反应:Na+:黄色;K+:紫色(透过蓝色钴玻璃观察);Ca2+:砖红色;
(2)H+:H+酸性。遇紫色石蕊试液变红,遇湿润蓝色石蕊试纸变红;
(3)NH4+:在试液中加强碱(NaOH)加热,产生使湿润红色石蕊试纸变蓝的气体;NH4++OH-
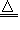 NH3↑+H2O;NH3+H2O
NH3↑+H2O;NH3+H2O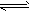 NH3?H2O
NH3?H2O NH4++OH-
NH4++OH- (4)Fe3+:①通KSCN或NH4SCN溶液呈血红色:Fe3++SCN-==[Fe(SCN)]2+;②通NaOH溶液红褐色沉淀:Fe3++3OH-==
Fe(OH)3↓
(5)Fe2+:①遇NaOH溶液生成白色沉淀在空气中迅速转化成灰绿色最后变成红褐色沉淀:Fe3++2OH-=Fe(OH)2↓;
4Fe(OH)2+O2+2H2O==4Fe(OH)3;
②试液中加KSCN少量无明显变化再加氯水出现血红色: 2Fe2++Cl2==2Fe3++2Cl-;Fe3++SCN-==[Fe(SCN)]2+
(6)Mg2+:遇NaOH溶液有白色沉淀生成,NaOH过量沉淀不溶解:Mg2++2OH-==Mg(OH)2↓,但该沉淀能溶于NH4Cl溶液;
(7)Al3+:遇NaOH溶液(适量)有白色沉淀生成,NaOH溶液过量沉淀溶解:Al3++3OH-==Al(OH)3↓;Al(OH)3+OH-==
AlO2-+2H2O
(8)Cu2+:遇NaOH溶液有蓝色沉淀生成,加强热变黑色沉淀:Cu2++2OH-==Cu(OH)2↓;Cu(OH)2
 CuO+H2O
CuO+H2O (9)Ba2+:遇稀H2SO4或硫酸盐溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ba2++SO42-==BaSO4↓
(10)Ag+: ①加NaOH溶液生成白色沉淀,此沉淀迅速转变为棕色沉淀溶于氨水Ag++OH-==AgOH↓;2AgOH==Ag2O+H2O;AgOH+2NH3?H2O==[Ag(NO3)2]OH+2H2O
②加稀HCl或可溶性氧化物溶液再加稀HNO3生成白色沉淀:Ag++Cl-==AgCl↓
(11)OH-:OH-碱性:①遇紫色石蕊试液变蓝;②遇酚酞试液变红;③遇湿润红色石蕊试纸变蓝;
(12)Cl-:遇AgNO3溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ag++Cl-=AgCl↓
(13)Br-:加AgNO3溶液有浅黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++Br-=AgBr↓
(14)I-: ①加AgNO3溶液有黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++I-=AgI↓;②加少量新制氯水后再加淀粉溶液显蓝色:2I-+Cl2=I2+2Cl-;I2遇淀粉变蓝
(15)S2-:①加强酸(非强氧化性)生成无色臭鸡蛋气味气体:S2-+2H+=H2S↑;②遇Pb(NO3)2或(CH3COO)2Pb试液生成黑色沉淀,遇CuSO4试液产生黑色沉淀:Pb2++S2-=PbS↓;Cu2++S2-=CuS↓
(16)SO42-:加可溶性钡盐[BaCl2或Ba(NO3)2]溶液有白色沉淀生成后再加稀HCl或稀HNO3沉淀不溶解:Ba2++SO42-=BaSO4↓
(17)SO32-:加强酸(H2SO4或HCl)把产生气体通入品红溶液中,品红溶液褪色:SO32-+2H+=H2O+SO2↑ SO2使品红溶液褪色
(18)CO32-:加稀HCl产生气体通入澄清石灰水,石灰水变浑浊:CO32-+2H+=H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O
(19)HCO3-:取含HCO3-盐溶液煮沸,放出无色无味、使澄清石灰水变浑浊的气体;或向HCO3-溶液里加入稀MgSO4溶液,无现象,加热煮沸有白色沉淀MgCO3生成,同时放出CO2气体。
(20)NO3-:浓缩试液加稀硫酸和铜片加热有红棕色气体产生,溶液变成蓝色:
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
(21)PO43-:加AgNO3溶液产生黄色沉淀,再加稀HNO3沉淀溶解:3Ag++PO43-=Ag3PO4↓;Ag3PO4溶于稀HNO3酸。
电化学计算的基本方法和技巧:
原电池和电解池的计算包括两极产物的定量计算、溶液的pH计算、相对原子质量的计算,根据电量求产物的量或根据产物的量求电量等。通常有下列三种方法。
1.根据电子守恒法
计算用于串联电路中阴、阳两极产物或正、负两极产物的量的计算,其依据是电路中转移的电子数相等。
2.根据总反应式计算
先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算。
3.根据关系式计算
运用得失电子守恒建立已知量与未知量之间的关系式。如以通过4mole一为桥梁可构建电极产物之间的如下关系式: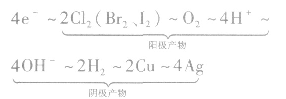
该关系式具有总揽电化学计算的作用和价值,熟记电极反应式,灵活运用这个关系式便能快速解答常见的电化学计算问题。
特别提醒:在电化学计算中,还常利用 和
和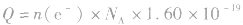 来计算电路中通过的电量。
来计算电路中通过的电量。
与“D、E为中学化学常见的金属单质,F是一种黑色晶体。E与C的浓溶...”考查相似的试题有:
- 某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁...
- (10分,每空2分)A、B、C、X均为中学化学常见的纯净物,它们之间有如下转化关系(副产物已略去)。(1)若X是空气中存在的强...
- 下图所示的是一些常见单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去。已知X、Y、Z是日常生活中常见金...
- (12分)在一定条件下,某些化学反应可以下图框架表示,根据要求回答下列问题:(1)若A、C、D均为含氯物质,且A的化合价介于...
- 元素X的单质及X与Y形成的化合物能按下图所示的关系发生转化,下列说法不正确的是( )A.X可能是金属B.X可能是非金属C.n可...
- 下图为中学化学中常见物质的转化关系,反应条件及部分反应物和产物未全部注明,已知A、D为金属单质,其他为化合物,试推断:(...
- 下列各组物质中,常温下能起反应产生气体的是[ ]A.铜跟稀硫酸B.铁跟浓硫酸C.铝跟浓硝酸D.铜跟浓硝酸
- 常温下,可以用铁或铝制容器盛装冷的浓硫酸,是因为浓硫酸使铁或铝发生了钝化,这表现了浓硫酸的( )A.吸水性B.脱水性C....
- 将两个铂电极插入500mLCuSO4溶液中进行电解,通电一段时间后,某一电极增重0.064g(设电解时该电极无氢气析出,且不考虑水解和...
- 废旧电池进入环境后,对人体带来一系列的致畸、致癌、致变等危害。废电池中主要有铜帽(含Cu、Zn)、锌壳、铁片、石墨、填充...