本试题 “在25℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断正确的是[ ]A.c(OH-)前者大于后者B.均存在电离平衡和水解平衡C.存在的粒子种类相同D.溶液中...” 主要考查您对弱电解质的电离
盐类水解的定义
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 弱电解质的电离
- 盐类水解的定义
定义:
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:
(2)动: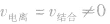 的动态平衡
的动态平衡
(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:

(2)动:
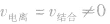 的动态平衡
的动态平衡(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
盐类水解:
1.定义:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类水解。
2.实质:生成弱电解质,使水的电离平衡被破坏而建立新的平衡。
3.条件:盐中必须有弱酸根离子或弱碱阳离子,盐溶于水。
4.特点:可逆性,写水解离子方程式时要用“ ” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
5.规律:有弱才水解,无弱不水解。谁弱谁水解,谁强显谁性。越弱越水解,都弱都水解。例如:25℃时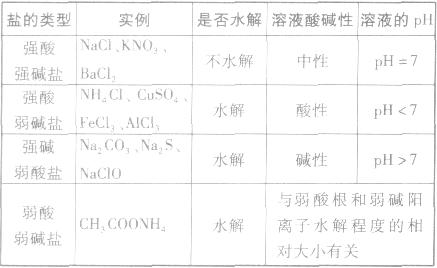
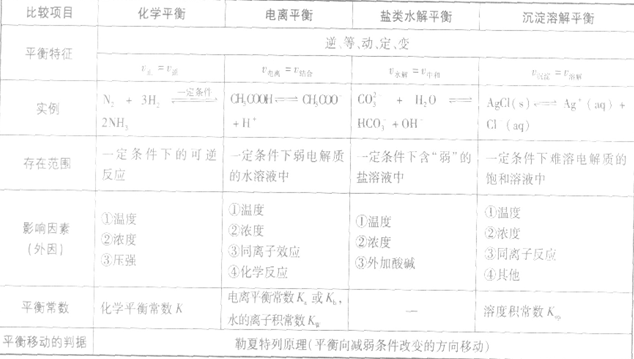
四种重要的动态平衡的比较:
发现相似题
与“在25℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判...”考查相似的试题有:
- (10分)(1)常温下,0.1 mol/L的醋酸和0.1 mol/L的盐酸各100 mL,分别与足量的锌粒反应,产生的气体体积前者__________后者(...
- (8分)在一定温度下,有a. 醋酸 b.硫酸 c.盐酸三种酸:(1)当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的...
- 将0.1mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时都会引起( )A.CH3COOH电离程度变大B.溶液的pH值变小C.溶液的导...
- 今有①CH3COOH;②HCl;③H2SO4三种溶液,(用“序号”和“>、<、=”填空)(1)当它们pH相同时,其物质的量浓度关系是______.(2...
- 已知25℃时,弱电解质的电离平衡常数:Ka(CH3COOH),Ka(HSCN)。在物质的量浓度均为mol·L的CH3COONa和NaSCN混合溶液中,下列排...
- 下列实际问题,不涉及到盐类水解原理的是( )A.草木灰不宜与铵盐氮肥混合施用B.用醋酸清洗保温瓶里的水垢C.配置FeCl3溶液...
- 下列各组数据关系中,前者比后者大的是( )A.常温常压下,pH =10的KOH溶液和pH=" 10" 的CH3COOK溶液中,由水电离的OH-浓度B...
- (10分)常温下,将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L混合溶液,(1)该溶液中存在的三个平衡体系是________________...
- 25℃时,将0.1mol·L-1的某碱MOH溶液与某一元酸HA的溶液等体积混合,混合后的溶液恰好为中性。下列判断正确的是( )A.HA溶液...
- 要求设计实验证明某种盐的水解是吸热的,下列回答正确的是( )A.将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的B...