本试题 “从回收的含铜电缆废料中提取铜时,假若设计如下两种方案,回答有关问题。方案甲:方案乙:(1)两个方案中,符合当前生产中绿色化学理念的是方案______,理由...” 主要考查您对铜盐(二价铜)
绿色化学
金属、非金属的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 铜盐(二价铜)
- 绿色化学
- 金属、非金属的有关计算
硫酸铜:
五水合硫酸铜(CuSO4·5H2O)为天蓝色晶体,水溶液呈弱酸性,俗名胆矾或蓝矾。硫酸铜是制备其他铜化合物的重要原料。同石灰乳混合可得波尔多液,用作杀菌剂。硫酸铜也是电解精炼铜时的电解液。
硫酸铜的物理性质和化学性质:
(1)物理性质:白色粉末状固体,不溶于乙醇和乙醚,易溶于水,水溶液呈蓝色,是强酸弱碱盐,水溶液呈弱酸性。将硫酸铜溶液浓缩结晶,可得五水硫酸铜蓝色晶体,俗称胆矾、铜矾或蓝矾。
(2)化学性质:
①二价铜与碱反应生成蓝色沉淀Cu(OH)2,Cu(OH)2溶于氨水形成深蓝色溶液[Cu(NH3)4]2+,此性质可以检验Cu2+。无水硫酸铜遇水变成蓝色(CuSO4·5H2O),可作为水的检验的依据。
②胆矾在常温常压下很稳定,不潮解,在干燥的空气中会逐渐风化(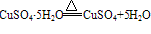 ),加热到45℃时失去2分子结晶水,110℃时失去4分子结晶水,150℃失去全部结晶水。将胆矾加热至650℃高温,可分解为黑色氧化铜、二氧化硫和氧气。
),加热到45℃时失去2分子结晶水,110℃时失去4分子结晶水,150℃失去全部结晶水。将胆矾加热至650℃高温,可分解为黑色氧化铜、二氧化硫和氧气。
(3)Cu2+的化学性质:能被活泼金属将其从盐溶液中置换出来:例:Cu2++Fe==Cu+Fe2+
硫酸铜的用途和制法:
(1)用途:硫酸铜较重要的铜盐之一,在电镀、印染、颜料、农药等方面有广泛的应用。无机农药波尔多液就是硫酸铜和消石灰的混合液,是一种良好的杀菌剂,可防止多种作物的病害。硫酸铜也常用来制备其他铜的化合物和电解精炼铜的电解液。
(2)制法:五水合硫酸铜可由铜或氧化铜与硫酸作用后,浓缩结晶而制得。在实验室中可用浓硫酸氧化金属铜来制取无水硫酸铜。
1.定义绿色化学是一门研究运用现代科学技术的原理和方法来减少或消除化学产品的设计、生产和应用中有害物质的使用与产生,使所研究开发的化学产品和过程对环境更加友好的学科。
2.绿色化学的基本原则
(1)防治污染的产生优于治理产生的污染;
(2)原子经济性(设计的合成方法应将反应过程中所用的材料,尽可能全部转化到最终产品中)即原子的利用率达到100%。
(3)应考虑到能源消耗对环境和经济的影响,并应尽量少地使用能源(在常温、常压下进行)。
包括金属及化合物、金属与非金属化合物、非金属化合物之间的反应的计算,解此类题的关键是正确的写出反应方程式,明确物质间的等量关系。明确物质之间的反应,正确写出方程式,此类题可迎刃而解。
AlCl3与NaOH反应的相关计算:
1、求Al(OH)3沉淀的量
2、求反应物碱的量
铝与酸、碱反应的计算规律:
铝分别与盐酸、氢氧化钠溶液反应的原理: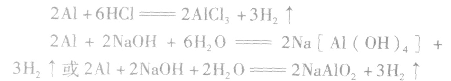
(1)等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气的体积比为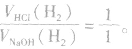
(2)足量的锅分别与等物质的量的盐酸和氢氧化钠溶液反应,产生氢气的体积比为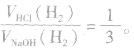
(3)一定量的铝分别和一定量的盐酸和氢氧化钠溶液反应,若产生氢气的体积比为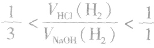 ,则必定是:
,则必定是:
①铝与盐酸反应时,铝过量而盐酸不足;
②铝与氢氧化钠溶液反应时,铝不足而氢氧化钠过量。
解有关硝酸与金属反应的计算题的技巧:
1.灵活运用得失电子守恒、原子守恒及溶液中的电荷守恒关系例如Cu与HNO3反应中就有以下等量关系:
(1)N原子守恒:反应前所有的N只存在于HNO3中;反应后含N的物质有HNO3的还原产物(假设此处有NO3、NO)和Cu(NO3)3,若HNO3过量,则过量HNO3中也含一部分N,则有:n(N)=n(NO2)+ n(NO)+2n[Cu(NO3)3]+n剩(HNO3)。
(2)得失电子守恒:在反应中失去电子的是参加反应的Cu, ;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),NO3-+e→ NO2、NO3-+3e→NO。根据得失电子守恒,则有:
;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),NO3-+e→ NO2、NO3-+3e→NO。根据得失电子守恒,则有: 
(3)溶液中的电荷守恒:在任何溶液中,阴离子所带负电荷总数与阳离子所带正电荷总数在数值上是相等的。在Cu与HNO3反应后的溶液中,若HNO3不过量,阳离子只有Cu2+,阴离子只有NO3-(此类计算不考虑H2O电离出的极少量的H+、OH-);若HNO3过量,溶液中阳离子有Cu2+和H+,阴离子只有NO3-。则有:
①若HNO3不过量: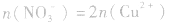
②若HNO3过量: 
2.铁与稀HNO3的反应规律 

(2)上述反应可以认为先发生反应①,若Fe有剩余则发生 ①×2+ ③即得反应②,所以,无论是反应①还是反应②,被还原的HNO3皆占参加反应的HNO3的
①×2+ ③即得反应②,所以,无论是反应①还是反应②,被还原的HNO3皆占参加反应的HNO3的 。
。
有关镁、铝的图像集锦:
Al(OH)3与Al3+、AlO2-之间的转化,是建立在 Al(OH)3两性基础上的,有关相互转化的配比和沉淀Al(OH)3的质量变化,见下表:
与“从回收的含铜电缆废料中提取铜时,假若设计如下两种方案,回...”考查相似的试题有:
- 物质A~F都是初中化学中的常见物质,它们有如右图所示的转化关系。回答下列问题(1)若A为固体非金属单质,E为红色固体单质,...
- 对于工农业生产和日常生活中与化学有关的问题,下列认识正确的是 ( )A.明矾净水与液氯净水的原理相同B.镀层破损后,镀铜...
- 海水中有丰富的化学资源,从海水中可提取多种化工原料,下图是海水综合利用——合成氨——纯碱的联合生产工艺流程:(1)写出反应...
- (8分)电镀广泛地应用于工业生产中。在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较...
- 金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和金属钙Ca,并含有3.5%(质量分数)CaO。(1)Ca元素原子结构示...
- 烟气中NOx是NO和NO2的混合物(不含N2O4)。(1)根据废气排放标准,1m3烟气最高允许含400mgNOx。若NOx中NO质量分数为0.85,则...
- 在由Fe 、Fe2O3组成的混合物中加入100mL2mol·L-1的盐酸,恰好使混合物完全溶解,并放出224mL气体(标准状况),此时向溶液中...
- 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中W的最高价氧化物对应的水化物的浓溶液能与Cu反应,生成有不可燃的气...
- 实验室欲使1.6 g Fe2O3完全被还原,事先应准备CO气体(在标准状况下)的体积为[ ]A.672 mLB.336 mLC.大于672 mLD.小于336 mL
- 现有浓度各为1mol/L的FeCl3、FeCl2、CuCl2的混合溶液100mL,加入一定量的铁粉,按下列情况填空(1)若反应完毕,铁粉有剩余:...