本试题 “在学习了木炭具有吸附性能之后,红红和明明同学在研究用木炭粉漂白红糖的原理.(1)他们将红糖置于盛有足量水的烧杯中溶解,得到的分散系属于悬浊液、乳浊液...” 主要考查您对常用仪器的名称和选用
蒸发
蒸馏
悬浊液、乳浊液
碳的性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 常用仪器的名称和选用
- 蒸发
- 蒸馏
- 悬浊液、乳浊液
- 碳的性质
常用的实验仪器:
试管、烧杯、蒸发皿、坩埚、酒精灯、漏斗、洗气瓶、干燥管、
托盘天平、量筒、容量瓶、滴定管、玻璃棒、量气装置等。
常用仪器对比分析:
试管、烧杯、蒸发皿、坩埚、酒精灯、漏斗、洗气瓶、干燥管、
托盘天平、量筒、容量瓶、滴定管、玻璃棒、量气装置等。
常用仪器对比分析:
|
常见的化学仪器 |
主要用途 | ||
|
分类 |
名称 |
图示 | |
| 用于加热仪器 | 试管 |  |
(1)用作少量试剂的反应容器,在常温或加热时使用 (2)作为小型气体发生器 (3)收集少量气体 |
| 蒸发皿 |  |
用于溶液的蒸发、浓缩 | |
| 燃烧匙 |  |
用于盛放可燃性固体物质进行燃烧实验 | |
| 烧杯 |  |
(1)溶解物质配制溶液 (2)较大量试剂反应容器 (3)常温或加热使用 | |
| 锥形瓶,烧瓶(圆底,平底) | 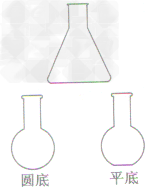 |
(1)用作较大量液体反应的容器和气体发生装置,在常温或加热时使用 (2)锥形瓶是蒸馏的接收容器 | |
| 酒精灯 | 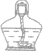 |
用于加热 | |
| 盛放物质的仪器 | 集气瓶 |  |
(1)收集和储存少量气体 (2)进行物质和气体之间的反应 |
| 滴瓶,滴管 | 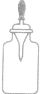 |
滴瓶用于盛放少量液体试剂 | |
| 细口瓶 | 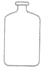 |
储存液体药品 | |
| 广口瓶 | 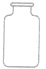 |
储存固体药品 | |
| 计量仪器 | 托盘天平 | 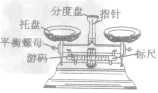 |
称量物质的质量(精确度为0.1g) |
| 量筒 |  |
量取一定体积的液体或间接测量气体的体积 | |
| 漏斗 | 普通漏斗 |  |
过滤,注入液体 |
| 长颈漏斗 |  |
用于注入液体 | |
| 分液漏斗 |  |
(1)注入液体 (2)分液漏斗用于分离两种密度不同且互不相溶的液体 | |
| 夹持仪器 | 铁架台 |  |
固定和放置各种仪器 |
| 试管夹 |  |
夹持试管进行简单的加热试验 | |
| 坩埚钳 |  |
夹持坩埚或夹持热的蒸发皿等 | |
| 辅助仪器 | 水槽 |  |
排水集气 |
| 药匙 |  |
取用固体药品(粉末状或小颗粒状) | |
| 玻璃棒 | 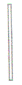 |
搅拌液体,引流,沾取液体 | |
| 石棉网 |  |
用于烧杯或烧瓶加热时垫在底部,使仪器受热均匀 | |
| 试管刷 |  |
用于刷洗试管等玻璃仪器 | |
| 温度计 |  |
用于测量温度 | |
定义:
液体温度低于沸点时,发生在液体表面的汽化过程,在任何温度下都能发生。蒸发量通常用蒸发掉的水层厚度的毫米数表示。
影响蒸发快慢的因素:
温度、湿度、液体的表面积、液体表面的空气流动等。
仪器:
铁架台(带铁圈)、酒精灯、玻璃棒、蒸发皿。
装置:

原理:
用加热的方法,使溶剂不断挥发而析出晶体,这是常用的一种结晶方法。
影响因素:
温度、湿度、液体的表面积、液体表面上方的空气流动的速度等。
主要因素:
(1)温度。温度越高,蒸发越快。因为在任何温度下,分子都在不断地运动,液体中总有一些速度较大的分子能蒸发仪器蒸发皿蒸发仪器蒸发皿够飞出液面脱离束缚而成为汽分子,所以液体在任何温度下都能蒸发。液体的温度升高,分子的平均动能增大,速度增大,从液面飞出去的分子数量就会增多,所以液体的温度越高,蒸发得就越快。
(2)液面表面积大小。如果液体表面面积增大,处于液体表面附近的分子数目增加,因而在相同的时间里,从液面飞出的分子数量就增多,所以液面面积越大,蒸发速度越快。
(3)液体表面上方空气流动的速度。当飞入空气里的汽分子和空气分子或其他汽分子发生碰撞时,有可能被碰回到液体中来。如果液面上方空气流动速度快,通风好,分子重新返回液体的机会越小,蒸发就越快。
注意事项:
①加热时要用玻璃棒不断地搅拌.防止液体局部温度过高,而发生飞溅;
⑦当蒸发皿里出现较多量同体时,停止加热,利用余热将水分蒸干;
③刚加热完与匕的蒸发皿不能用手拿取,也不能用冷水冲洗;
④如果要用烧杯浓缩溶液,加热时要垫上石棉网,以防烧杯受热小均匀而破裂。
操作口诀:
皿中液体不宜多,防止飞溅要搅动。
较多固体析出时,移去酒灯自然蒸。
液体温度低于沸点时,发生在液体表面的汽化过程,在任何温度下都能发生。蒸发量通常用蒸发掉的水层厚度的毫米数表示。
影响蒸发快慢的因素:
温度、湿度、液体的表面积、液体表面的空气流动等。
仪器:
铁架台(带铁圈)、酒精灯、玻璃棒、蒸发皿。
装置:

原理:
用加热的方法,使溶剂不断挥发而析出晶体,这是常用的一种结晶方法。
影响因素:
温度、湿度、液体的表面积、液体表面上方的空气流动的速度等。
主要因素:
(1)温度。温度越高,蒸发越快。因为在任何温度下,分子都在不断地运动,液体中总有一些速度较大的分子能蒸发仪器蒸发皿蒸发仪器蒸发皿够飞出液面脱离束缚而成为汽分子,所以液体在任何温度下都能蒸发。液体的温度升高,分子的平均动能增大,速度增大,从液面飞出去的分子数量就会增多,所以液体的温度越高,蒸发得就越快。
(2)液面表面积大小。如果液体表面面积增大,处于液体表面附近的分子数目增加,因而在相同的时间里,从液面飞出的分子数量就增多,所以液面面积越大,蒸发速度越快。
(3)液体表面上方空气流动的速度。当飞入空气里的汽分子和空气分子或其他汽分子发生碰撞时,有可能被碰回到液体中来。如果液面上方空气流动速度快,通风好,分子重新返回液体的机会越小,蒸发就越快。
注意事项:
①加热时要用玻璃棒不断地搅拌.防止液体局部温度过高,而发生飞溅;
⑦当蒸发皿里出现较多量同体时,停止加热,利用余热将水分蒸干;
③刚加热完与匕的蒸发皿不能用手拿取,也不能用冷水冲洗;
④如果要用烧杯浓缩溶液,加热时要垫上石棉网,以防烧杯受热小均匀而破裂。
操作口诀:
皿中液体不宜多,防止飞溅要搅动。
较多固体析出时,移去酒灯自然蒸。
定义:
指利用液体混合物中各组分挥发性的差异而将组分分离的传质过程。将液体沸腾产生的蒸气导入冷凝管,使之冷却凝结成液体的一种蒸发、冷凝的过程。
蒸馏是分离沸点相差较大的混合物的一种重要的操作技术,尤其是对于液体混合物的分离有重要的实用意义。
即,蒸馏条件:1.液体是混合物。2.各组分沸点不同。
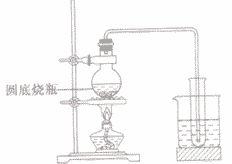
实验室制蒸馏水:
(1)原理:蒸馏是利用互相溶解的液体混合物中各组分沸点小同进行分离提纯的操作。其过程是:加热样品使其中某组分汽化,然后使蒸气冷凝为液体加以收集。
(2)仪器:铁架台、蒸馏烧瓶、冷凝管、尾接管、锥形瓶、温度计、酒精灯、石棉网等。
(3)装置:
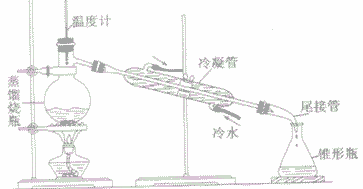
(4)操作:
①用洒精灯外焰给受热仪器先预热后加热
②对蒸馏烧瓶(烧杯、烧瓶、锥形瓶等仪器)加热时,不能直接加热,一定要垫石棉网,蒸馏烧瓶中液体体积为容器容积的1/3—2/3
③温度计不能直接插人蒸馏烧瓶的液体之中,应使温度计水银球与蒸馏烧瓶支管口位于同一水平线上
④蒸馏烧瓶的支管必须露出橡皮塞以防蒸馏出来的液体接触橡皮塞而带入杂质
⑤冷凝管中冷水的走向应是下口进、上口出,以使蒸汽充分冷却。
(5)关键:
①控制好加热温度。如果采用加热浴,加热浴的温度应当比蒸馏液体的沸点高出若干度,否则难以将被蒸馏物蒸馏出来。加热浴温度比蒸馏液体沸点高出的越多,蒸馏速度越快。但是,加热浴的温度也不能过高,否则会导致蒸馏瓶和冷凝器上部的蒸气压超过大气压,有可能产生事故,特别是在蒸馏低沸点物质时尤其需注意。一般地,加热浴的温度不能比蒸馏物质的沸点高出30℃。整个蒸馏过程要随时添加浴液,以保持浴液液面超过瓶中的液面至少一公分。
②蒸馏高沸点物质时,由于易被冷凝,往往蒸气未到达蒸馏烧瓶的侧管处即已经被冷凝而滴回蒸馏瓶中。因此,应选用短颈蒸馏瓶或者采取其它保温措施等,保证蒸馏顺利进行。
③蒸馏之前,必须了解被蒸馏的物质及其杂质的沸点和饱和蒸气压,以决定何时(即在什么温度时)收集馏分。
④蒸馏烧瓶应当采用圆底烧瓶。沸点在40-150℃的液体可采用150℃以上的液体,或沸点虽在150℃以下,对热不稳常压的简单蒸馏。对于沸点在定、易热分解的液体,可以采用减压蒸馏和水蒸汽蒸馏。
(6)简易装置
(7)应用
①水的净化
②石油的分馏
(8)蒸馏化学口诀
隔网加热冷管倾,上缘下缘两相平。
需加碎瓷防暴沸,热气冷水逆向行。
瓶中液限掌握好,先撤酒灯水再停。
指利用液体混合物中各组分挥发性的差异而将组分分离的传质过程。将液体沸腾产生的蒸气导入冷凝管,使之冷却凝结成液体的一种蒸发、冷凝的过程。
蒸馏是分离沸点相差较大的混合物的一种重要的操作技术,尤其是对于液体混合物的分离有重要的实用意义。
即,蒸馏条件:1.液体是混合物。2.各组分沸点不同。
实验室制蒸馏水:
(1)原理:蒸馏是利用互相溶解的液体混合物中各组分沸点小同进行分离提纯的操作。其过程是:加热样品使其中某组分汽化,然后使蒸气冷凝为液体加以收集。
(2)仪器:铁架台、蒸馏烧瓶、冷凝管、尾接管、锥形瓶、温度计、酒精灯、石棉网等。
(3)装置:

(4)操作:
①用洒精灯外焰给受热仪器先预热后加热
②对蒸馏烧瓶(烧杯、烧瓶、锥形瓶等仪器)加热时,不能直接加热,一定要垫石棉网,蒸馏烧瓶中液体体积为容器容积的1/3—2/3
③温度计不能直接插人蒸馏烧瓶的液体之中,应使温度计水银球与蒸馏烧瓶支管口位于同一水平线上
④蒸馏烧瓶的支管必须露出橡皮塞以防蒸馏出来的液体接触橡皮塞而带入杂质
⑤冷凝管中冷水的走向应是下口进、上口出,以使蒸汽充分冷却。
(5)关键:
①控制好加热温度。如果采用加热浴,加热浴的温度应当比蒸馏液体的沸点高出若干度,否则难以将被蒸馏物蒸馏出来。加热浴温度比蒸馏液体沸点高出的越多,蒸馏速度越快。但是,加热浴的温度也不能过高,否则会导致蒸馏瓶和冷凝器上部的蒸气压超过大气压,有可能产生事故,特别是在蒸馏低沸点物质时尤其需注意。一般地,加热浴的温度不能比蒸馏物质的沸点高出30℃。整个蒸馏过程要随时添加浴液,以保持浴液液面超过瓶中的液面至少一公分。
②蒸馏高沸点物质时,由于易被冷凝,往往蒸气未到达蒸馏烧瓶的侧管处即已经被冷凝而滴回蒸馏瓶中。因此,应选用短颈蒸馏瓶或者采取其它保温措施等,保证蒸馏顺利进行。
③蒸馏之前,必须了解被蒸馏的物质及其杂质的沸点和饱和蒸气压,以决定何时(即在什么温度时)收集馏分。
④蒸馏烧瓶应当采用圆底烧瓶。沸点在40-150℃的液体可采用150℃以上的液体,或沸点虽在150℃以下,对热不稳常压的简单蒸馏。对于沸点在定、易热分解的液体,可以采用减压蒸馏和水蒸汽蒸馏。
(6)简易装置

(7)应用
①水的净化
②石油的分馏
(8)蒸馏化学口诀
隔网加热冷管倾,上缘下缘两相平。
需加碎瓷防暴沸,热气冷水逆向行。
瓶中液限掌握好,先撤酒灯水再停。
定义:悬浊液:固体小颗粒悬浮在液体里形成的混合物。
乳浊液:小液滴分散到液体里形成的混合物
说明:固体小颗粒是由许多分子集合而成的,小液滴也是由许多分子集合而成的,故悬浊液和乳浊液是不均一,不稳定的混合物
溶液、悬浊液、乳浊液的比较:
乳浊液:小液滴分散到液体里形成的混合物
说明:固体小颗粒是由许多分子集合而成的,小液滴也是由许多分子集合而成的,故悬浊液和乳浊液是不均一,不稳定的混合物
溶液、悬浊液、乳浊液的比较:
| 项目 | 溶液 | 悬浊液 | 乳浊液 |
| 概念 | 一种或几种物质分散到另一种物质中形成均一、稳定的混合物 | 固体小颗粒悬浮于液体里形成的混合物 | 小液滴分散在液体中形成的混合物 |
| 溶解性 | 溶 | 不溶 | 不溶 |
| 状态 | 固、液、气 | 固 | 液 |
| 分散在水里的粒子 | 分子或离子 | 许多分子的集合体 | 许多分子的集合体 |
| 现象 | 透明且均一 | 浑浊、不均一 | 浑浊、不均一 |
| 久置现象 | 不变(稳定) | 沉淀 | 分上、下两层(不稳定) |
| 应用 | 可湿性粉剂、农药 | 医疗,农业生产 | |
| 举例 | 蔗糖溶液,食盐溶液 | 泥土与水的混合物 | 植物油和水的混合物 |
| 相同点 | 都是物质分散到另一种物质中形成的混合物 | ||
概述:
碳是一种非金属元素,位于元素周期表的第二周期IVA族。拉丁语为Carbonium,意为“煤,木炭”。汉字“碳”字由木炭的“炭”字加石字旁构成,从“炭”字音。碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳之中。碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。碳是生铁、熟铁和钢的成分之一。碳能在化学上自我结合而形成大量化合物,在生物上和商业上是重要的分子。生物体内大多数分子都含有碳元素。
碳的存在形式:
碳的存在形式是多种多样的,有晶态单质碳如金刚石、石墨;有无定形碳如煤;有复杂的有机化合物如动植物等;碳酸盐如大理石等。单质碳的物理和化学性质取决于它的晶体结构。高硬度的金刚石和柔软滑腻的石墨晶体结构不同,各有各的外观、密度、熔点等。
碳的化学性质:
1.稳定性:在常温下碳的化学性质稳定,点燃或高温的条件下能发生化学反应
2.可燃性:
氧气充足的条件下:C+O2 CO2
CO2
氧气不充分的条件下:2C+O2 2CO
2CO
3.还原性:
木炭还原氧化铜:C+2CuO 2Cu+CO2↑
2Cu+CO2↑
焦炭还原氧化铁:3C+2Fe2O3 4Fe+3CO2↑
4Fe+3CO2↑
焦炭还原四氧化三铁:2C+Fe3O4 3Fe+2CO2↑
3Fe+2CO2↑
木炭与二氧化碳的反应:C+CO2 CO
CO
碳”与“炭”的区别:
“碳”是一种核电荷数为6的非金属元素,而“炭” 一般是指由石墨的微小晶体和少量杂质组成的混合物,如木炭、焦炭、活性炭、炭黑等。在说明碳元素时,用“碳”表示,如碳单质、二氧化碳、碳酸等;在说明含石墨的无定形碳时,用“炭”表示,如木炭、焦炭等。
碳燃烧生成物的判断:
氧气量充足时,碳充分燃烧:C+O2 CO2
CO2
氧气量不充足时,碳不充分燃烧:2C+O2 2CO
2CO
mg碳与ng氧气反应:
①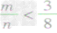 时,生成物只有CO,且O2有剩余;
时,生成物只有CO,且O2有剩余;
②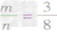 时,恰好完全反应生成CO2;
时,恰好完全反应生成CO2;
③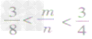 时,生成物既有CO2,也有CO;
时,生成物既有CO2,也有CO;
④ 时,恰好完全反应生成CO;
时,恰好完全反应生成CO;
⑤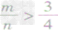 时,生成物只有CO,且C有剩余。
时,生成物只有CO,且C有剩余。
碳单质及其化合物间的转化:
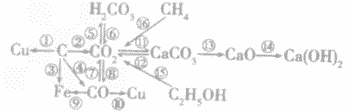
(1)C+2CuO 2Cu+CO2↑
2Cu+CO2↑
(2)C+O2 CO2
CO2
(3)3C+2Fe2O3 4Fe+3CO2↑
4Fe+3CO2↑
(4)2C+O2 2CO
2CO
(5)CO2 + H2O===H2CO3
(6)H2CO3==CO2 + H2O
(7)2CO + O2 2CO2
2CO2
(8)C+CO2 2CO
2CO
(9)3CO + Fe2O3 2Fe + 3CO2
2Fe + 3CO2
(10)CO+ 2CuO 2Cu + CO2
2Cu + CO2
(11)Ca(OH)2 + CO2====CaCO3↓+ H2O
(12)CaCO3+2HCl==CaCl2+CO2↑+H2O
(13)CaCO3 CaO+CO2
CaO+CO2
(14)CaO+H2O==Ca(OH)2
(15)C2H5OH+3O2 2CO2+3H2O
2CO2+3H2O
(16)CH4+O2 CO2+2H2O
CO2+2H2O
碳是一种非金属元素,位于元素周期表的第二周期IVA族。拉丁语为Carbonium,意为“煤,木炭”。汉字“碳”字由木炭的“炭”字加石字旁构成,从“炭”字音。碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳之中。碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。碳是生铁、熟铁和钢的成分之一。碳能在化学上自我结合而形成大量化合物,在生物上和商业上是重要的分子。生物体内大多数分子都含有碳元素。
碳的存在形式:
碳的存在形式是多种多样的,有晶态单质碳如金刚石、石墨;有无定形碳如煤;有复杂的有机化合物如动植物等;碳酸盐如大理石等。单质碳的物理和化学性质取决于它的晶体结构。高硬度的金刚石和柔软滑腻的石墨晶体结构不同,各有各的外观、密度、熔点等。
碳的化学性质:
1.稳定性:在常温下碳的化学性质稳定,点燃或高温的条件下能发生化学反应
2.可燃性:
氧气充足的条件下:C+O2
 CO2
CO2 氧气不充分的条件下:2C+O2
 2CO
2CO 3.还原性:
木炭还原氧化铜:C+2CuO
 2Cu+CO2↑
2Cu+CO2↑ 焦炭还原氧化铁:3C+2Fe2O3
 4Fe+3CO2↑
4Fe+3CO2↑ 焦炭还原四氧化三铁:2C+Fe3O4
 3Fe+2CO2↑
3Fe+2CO2↑ 木炭与二氧化碳的反应:C+CO2
 CO
CO 碳”与“炭”的区别:
“碳”是一种核电荷数为6的非金属元素,而“炭” 一般是指由石墨的微小晶体和少量杂质组成的混合物,如木炭、焦炭、活性炭、炭黑等。在说明碳元素时,用“碳”表示,如碳单质、二氧化碳、碳酸等;在说明含石墨的无定形碳时,用“炭”表示,如木炭、焦炭等。
碳燃烧生成物的判断:
氧气量充足时,碳充分燃烧:C+O2
 CO2
CO2 氧气量不充足时,碳不充分燃烧:2C+O2
 2CO
2CO mg碳与ng氧气反应:
①
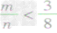 时,生成物只有CO,且O2有剩余;
时,生成物只有CO,且O2有剩余;②
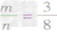 时,恰好完全反应生成CO2;
时,恰好完全反应生成CO2; ③
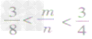 时,生成物既有CO2,也有CO;
时,生成物既有CO2,也有CO;④
 时,恰好完全反应生成CO;
时,恰好完全反应生成CO; ⑤
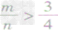 时,生成物只有CO,且C有剩余。
时,生成物只有CO,且C有剩余。 碳单质及其化合物间的转化:

(1)C+2CuO
 2Cu+CO2↑
2Cu+CO2↑ (2)C+O2
 CO2
CO2(3)3C+2Fe2O3
 4Fe+3CO2↑
4Fe+3CO2↑ (4)2C+O2
 2CO
2CO (5)CO2 + H2O===H2CO3
(6)H2CO3==CO2 + H2O
(7)2CO + O2
 2CO2
2CO2 (8)C+CO2
 2CO
2CO(9)3CO + Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 (10)CO+ 2CuO
 2Cu + CO2
2Cu + CO2 (11)Ca(OH)2 + CO2====CaCO3↓+ H2O
(12)CaCO3+2HCl==CaCl2+CO2↑+H2O
(13)CaCO3
 CaO+CO2
CaO+CO2 (14)CaO+H2O==Ca(OH)2
(15)C2H5OH+3O2
 2CO2+3H2O
2CO2+3H2O(16)CH4+O2
 CO2+2H2O
CO2+2H2O 发现相似题
与“在学习了木炭具有吸附性能之后,红红和明明同学在研究用木炭...”考查相似的试题有:
- 实验室配制50g 5%的氢氧化钠溶液,所需仪器除药匙、托盘天平、量筒外,还需要的仪器是______;如果现有三种量筒:100mL、50mL...
- 山东省海域辽阔,盛产海带,海带中含有丰富的碘.为了从海带中提取碘,某研究小组设计并进行了以下实验:请你填写下列空白:...
- 下列有关溶液的说法正确的是A.盐水的沸点比水低B.无色澄清液体一定是溶液C.只有固体能作溶质D.溶液的各部分性质均相同
- 向下图试管里的水中加入下述某种物质后,原来U型管内在同一水平上的红墨水,右边液面降低了些,左边液面上升了些,则加入的物...
- 用我们学习的化学知识判断下列做法不正确的是( )A.用白醋除去热水瓶中的水垢B.用熟石灰改良碱性土壤C.用活性炭除去冰箱...
- 宣传科学知识.介绍高新科技.揭露伪科学是科学工作者的义务.下列各项中属于伪科学的是( )A.高温高压下将石墨制成金刚石B...
- 碳元素可形成多种单质和化合物.(1)天然存在的最硬的、可用来裁玻璃的物质是______(填名称).(2)电车与电缆接触的部分...
- 现有几种物质:①稀有气体;②氢气;③熟石灰;④酒精;⑤活性炭.用序号填空:碘酒中的溶剂是______;通电时能发出不同颜色光的是...
- 下列关于金刚石和石墨的说法中,正确的是( )A.都是由碳元素组成的单质B.有相同的物理性质C.它们的碳原子结构不同D.都可...
- 下表列出了1 cm3活性炭在常温常压下所能吸附的常见气体的体积,试分析活性炭吸附气体的难易跟气体的哪些性质有关 。