本试题 “钠是一种非常活拨的金属,遇空气中的氧或水等物质均会发生化学反应。工业上给密封状态下电解池中的熔融的NaCl通入直流电,NaCl发生分解得到金属钠和氯气。请...” 主要考查您对复分解反应
化学反应方程式的书写
原子结构示意图
离子结构示意图
构成物质的微粒(分子、原子、离子)
化合价的求法
金属的化学性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 复分解反应
- 化学反应方程式的书写
- 原子结构示意图
- 离子结构示意图
- 构成物质的微粒(分子、原子、离子)
- 化合价的求法
- 金属的化学性质
复分解反应:
(1)概念:两种化合物互相交换成分,生成另外两种化合物的反应,形如AB+CD==AD+CB
(2)特点:
①一般在水溶液里进行,两种化合物中的离子互换。
②元素的化合价不改变。
(3)复分解反应的实质:复分解反应从微观角度看,是反应物之间相互交换离子,阴、阳离子重新结合生成沉淀或气体或水。如酸与碱发生中和反应的实质为:H++OH-==H2O。
复分解反应发生的条件:
常见的复分解反应:
①常见的有沉淀生成的复分解反应
Na2CO3+Ca(OH)2=CaCO3+2NaOH
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
FeCl3+3NaOH==Fe(OH)3↓+3NaCl
NaCl+AgNO3==AgCl↓+NaNO3
H2SO4+BaCl2==BaSO4↓+2HCl
②常见的有气休生成的复分解反应
CaCO3+2HCl==CaCl2+H2O+CO2↑
2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O
③常见的有水生成的复分解反应
NaOH+HCl==NaCl+H2O
Na2CO3+HCl==NaCl+H2O+CO2↑
易错点:
例如CO2+Ca(OH)2====CaCO3↓+H2O这样的反应不是复分解反应。因为,根据复分解反应的定义。只有两种化合物互相交换成分,生成两种新的化合物的反应才是复分解反应。如:H2SO4+BaCl2====BaSO4↓+2HCl这个反应中,硫酸的成分(氢离子和硫酸根离子)与氯化钡的成分(氯离子和钡离子)互相交换,形成了硫酸钡和盐酸。而CO2+Ca(OH)2==CaCO3↓+H2O反应中二氧化碳的成分(C和O2)并没有与氢氧化钙的成分(钙离子和氢氧根离子)互相交换,所以这样的反应不是复分解反应。同理,CO2+2NaOH==Na2CO3+H2O和SO2+2NaOH===Na2SO3+H2O之类的反应也不是复分解反应。
(1)概念:两种化合物互相交换成分,生成另外两种化合物的反应,形如AB+CD==AD+CB
(2)特点:
①一般在水溶液里进行,两种化合物中的离子互换。
②元素的化合价不改变。
(3)复分解反应的实质:复分解反应从微观角度看,是反应物之间相互交换离子,阴、阳离子重新结合生成沉淀或气体或水。如酸与碱发生中和反应的实质为:H++OH-==H2O。
复分解反应发生的条件:
| 规律 | 发生的条件 |
| 金属氧化物+酸 | 生成物中有水,一般都能反应 |
| 酸+碱→盐+水 | 中和反应,有水生成,一般都能反应 |
| 酸+盐→新酸+新盐 | 生成物种有沉淀,气体或水 |
| 碱+盐→新碱+新盐 | 生成物种有沉淀,气体或水 |
| 盐1+盐2→新盐1+新盐2 | 生成物种有沉淀 |
常见的复分解反应:
①常见的有沉淀生成的复分解反应
Na2CO3+Ca(OH)2=CaCO3+2NaOH
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
FeCl3+3NaOH==Fe(OH)3↓+3NaCl
NaCl+AgNO3==AgCl↓+NaNO3
H2SO4+BaCl2==BaSO4↓+2HCl
②常见的有气休生成的复分解反应
CaCO3+2HCl==CaCl2+H2O+CO2↑
2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O
③常见的有水生成的复分解反应
NaOH+HCl==NaCl+H2O
Na2CO3+HCl==NaCl+H2O+CO2↑
易错点:
例如CO2+Ca(OH)2====CaCO3↓+H2O这样的反应不是复分解反应。因为,根据复分解反应的定义。只有两种化合物互相交换成分,生成两种新的化合物的反应才是复分解反应。如:H2SO4+BaCl2====BaSO4↓+2HCl这个反应中,硫酸的成分(氢离子和硫酸根离子)与氯化钡的成分(氯离子和钡离子)互相交换,形成了硫酸钡和盐酸。而CO2+Ca(OH)2==CaCO3↓+H2O反应中二氧化碳的成分(C和O2)并没有与氢氧化钙的成分(钙离子和氢氧根离子)互相交换,所以这样的反应不是复分解反应。同理,CO2+2NaOH==Na2CO3+H2O和SO2+2NaOH===Na2SO3+H2O之类的反应也不是复分解反应。
化学方程式的书写原则遵循两个原则:
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。
化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3 CaO+ CO2↑
CaO+ CO2↑
(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2 CO2
CO2
(3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2 2CuO
2CuO
④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2
 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。 化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
| 常见错误 | 违背规律 |
| 写错物质的化学式 | 客观事实 |
| 臆造生成物或事实上不存在的化学反应 | |
| 写错或漏泄反应条件 | |
| 化学方程式没有配平 | 质量守恒 |
| 漏标多标“↑”、“↓”符号 | —— |
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4
 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。 ③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3
 CaO+ CO2↑
CaO+ CO2↑(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2
 CO2
CO2 (3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2
 2CuO
2CuO ④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
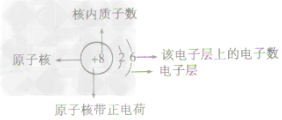
概念:
原子结构示意图(如图)是表示原子核电荷数和电子层排布的图示形式。小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数。
原子结构示意图及各部分的含义:
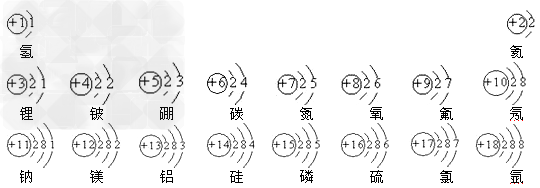
前20号元素的原子结构示意图:
原子结构示意图(如图)是表示原子核电荷数和电子层排布的图示形式。小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数。
原子结构示意图及各部分的含义:

前20号元素的原子结构示意图:

概念:
离子结构示意图是用来表示离子核电荷数和电子排布的图示.同种元素的原子和离子其质子数相同.离子的核外电子数和质子数不同,阳离子的质子数大于核电荷数,阴离子的质子数小于核外电子数.主族元素的离子最外层一般为8个电子(最外层是K层为2个电子)。
阴阳离子的结构示意图与原子结构示意图的的区别:
1、结构示意图中,圆圈里的数字=半弧上的数字之和,它就是原子结构示意图。
2、结构示意图中,圆圈里的数字>半弧上的数字之和,它就是阳离子结构示意图。
3、结构示意图中,圆圈里的数字<半弧上的数字之和,它就是阴离子结构示意图。
离子结构示意图是用来表示离子核电荷数和电子排布的图示.同种元素的原子和离子其质子数相同.离子的核外电子数和质子数不同,阳离子的质子数大于核电荷数,阴离子的质子数小于核外电子数.主族元素的离子最外层一般为8个电子(最外层是K层为2个电子)。
阴阳离子的结构示意图与原子结构示意图的的区别:
1、结构示意图中,圆圈里的数字=半弧上的数字之和,它就是原子结构示意图。
2、结构示意图中,圆圈里的数字>半弧上的数字之和,它就是阳离子结构示意图。
3、结构示意图中,圆圈里的数字<半弧上的数字之和,它就是阴离子结构示意图。
构成物质的微粒:
分子、原子、离子是构成物质的基本微粒。
分子,原子,离子的比较:
分子和原子的比较:
原子与离子的比较:
分子、原子、离子是构成物质的基本微粒。
分子,原子,离子的比较:
| 分子 | 原子 | 离子 | |
| 概念 | 保持物质化学性质的最小粒子 | 是化学变化中的最小粒子 | 带电的原子或原子团 |
| 表示方法 | 用化学式表示. 如H2,He | 用元素符号表示,如H,Fe | 用离子符号表示,如Na+、NO3- |
| 微粒的运动 | 物理变化是分子运动的结果,如:水的蒸发 | 化学变化是原子运动的结果. 如:水的电解 | 离子运动的结果可能是物理变化。也可能是化学变化,如:NaCl的溶解是物理变化, NaCl与AgNO3反应是化学变化 |
| 化学计量数与符号的关系 | 化学式、元素符号、离子符号前加上化学计量数,如2H,2H2,3Na+,只表示原子、分子、离了的“个数”,不表示元素和物质 | ||
| 联系 |  | ||
分子和原子的比较:
| 原子 | 分子 | |
| 定义 | 化学变化中的最小粒子 | 保持物质(由分子直接构成的物质)化学性质的最小粒子 |
| 相同点 | ①都是构成物质的基本粒子,有些物质是由分子构成的.有些物质是由原子直接构成的; ②都很小,但者阶一定的体积和质量; ③都在不断地运动; ④微粒子间都有间隔; ⑤都能保持物质的化学性质 | |
| 区别 | 化学变化中不能再分 | 化学变化中可以再分 |
| 如:在电解水实验中,水分子可以分成氢原子和氧原子,而氢原子和氧原子不可以再分,只是重新组合成氢分子、氧分子 | ||
| 同种原子具有相同的质子数 | 同种分子化学性质相同 | |
| 联系 |  | |
原子与离子的比较:
| 原子 | 离子 | |
| 概念 | 化学变化中最小粒子 | 带电荷的原子或原子团 |
| 电性 | 呈电中性,不带电 | 带电: 阳离子带正电 阴离子带负电 |
| 表示方法 | 用元素符号表示;Na 表示钠原子,2Na表示2个钠原子 | 在元素符号右上角先写电荷数,后标出电性 (+、-):Na+表示钠离子,2Na+表示2个钠离子 |
| 数量关系 | 核内质子数=核外电子数 | 阳离子:核内质子数> 核外电子数 阴离子:核内质子数< 核外电子数 |
| 相似点 | 都是构成物质的一种粒子 | |
| 转化 |  | |
求化合价:
化合价是元素的一种性质,它只有在元素彼此化合时才表现出来。在化合物中正、负化合价代数和等于零,这是求化合价的准则。
几种求法:
一、由化学式或根式
1.求AmBn化合物中A元素化合价的公式: (B元素的化合价×B的原子个数)/A的原子个数
2.求多元化合物中未知化合价的元素的化合价公式: (已知化合价诸元素价数的代数和)/未知化合价的元素的原子个数
3.根据正、负电荷数判断元素(或原子团)的化合价。 在根式中,正、负化合价总价数的代数和等于根式所带的正、负电荷数。
二、由元素质量比
1.(A元素的相对原子质量×B元素的化合价)/(B元素的相对原子质量×元素的化合价)=A元素的质量比值/B元素的质量比值
2.A元素的质量比值(或百分组成)×A的化合价/A的相对原子质量=B元素的质量比值(或百分比组成)×B的化合价/B相对原子质量
三、由质量比
(B的化合价×A的相对原子质量比值)/(A的化合价×B的相对原子质量比值)=A元素的质量比值/B元素的质量比值
正负代化合价数和为零:
【例1】试确定化合物K2MnO4中Mn元素的化合价。 解析:设化合物中Mn元素化合价为+x价,依化合物中各元素化合价正负代数和为零的原则有2×(+1)+1×(+x)+4×(-2)=0解之得x=6 故K2MnO4中Mn元素化合价为+6价。
电子层结构法
【例2】元素X的原子最外层上有1个电子,元素Y的原子最外层上有6个电子,则X、Y两元素可形成的化合物的化学式为[] A.XYB.X2YC.XY2D.X3Y 解析:本题的关键可以说是首先得确定在形成化合物时,X、Y两元素所表现的化合价。因X最外层上只有1个电子,最高正价为+1价,Y最外层6个电子,离8电子稳定结构尚差2个,故最低负价为-2价,则X、Y所形成化合物分子式为X2Y,应选B。
质量分数法
【例3】某元素的相对原子质量为59,在其氧化物中该元素的质量分数为71%,则它的化合价为[] A.+1B.+2C.+3D.+4 解析:设该元素的氧化物化学式为RxOy 依题意有59x/(59x+16y)*100%=71% 解得x/y=2:3 故化学式为R2O3,R化合价为+3价,选C。
质量守恒定律法
【例4】某金属氧化物与足量的盐酸反应,生成的氯化物与水的分子数之比为2∶3,则该金属的化合价是[] A.+1B.+2C.+3D.+4
解析:设生成的氯化物化学式为RClx,依题意有分子数之比RClx∶H2O=2∶3根据质量守恒定律可知,反应前后各元素的原子种类和数目不变,生成物中H、Cl的原子个数比也应为1:1,故x值为3,则R的化合价为+3价,选C。
相对分子质量法
【例5】某金属元素的氧化物相对分子质量为M,同价态的氯化物相对分子质量为N,则该元素的化合价数值为[]
解析:设该元素化合价为+x价,相对原子质量为MR
(1)如x为奇数时,氧化物化学式为R2Ox,氯化物化学式为RClx,据题意有
2MR+16x=M(1)
MR+35.5x=N(2)
(2)*2-(1)得x的值为x=+(2N-M)/55
(2)x为偶数时,氧化物化学式为Rox/2氯化物化学式为RClx,据题意有 MR+35.5x=N(4) x=+(N-M)/27.5
质量关系法
【例6】相对原子质量为M的金属单质ag与足量的稀硫酸反应,产生bg氢气,则反应中该金属元素的化合价为[]
解析:设金属在反应中化合价为+x价,则金属单质与生成H2有如下关系:
2R~xH2
2M 2x
a b
故应选B。
相关因素讨论法
【例7】某元素M原子最外层电子数少于5,其氧化物化学式为MxOy,氯化物化学式MClz当y∶z=1∶2时,M的化合价可能是[]
A.+1B.+2C.+3D.+4
解析:M的化合价在数值上等于z的值
如y=1z=2(合理) y=2z=4(合理) y=3z=6(与最外层电子数少于5不符) 故应选B、D。
化合价是元素的一种性质,它只有在元素彼此化合时才表现出来。在化合物中正、负化合价代数和等于零,这是求化合价的准则。
几种求法:
一、由化学式或根式
1.求AmBn化合物中A元素化合价的公式: (B元素的化合价×B的原子个数)/A的原子个数
2.求多元化合物中未知化合价的元素的化合价公式: (已知化合价诸元素价数的代数和)/未知化合价的元素的原子个数
3.根据正、负电荷数判断元素(或原子团)的化合价。 在根式中,正、负化合价总价数的代数和等于根式所带的正、负电荷数。
二、由元素质量比
1.(A元素的相对原子质量×B元素的化合价)/(B元素的相对原子质量×元素的化合价)=A元素的质量比值/B元素的质量比值
2.A元素的质量比值(或百分组成)×A的化合价/A的相对原子质量=B元素的质量比值(或百分比组成)×B的化合价/B相对原子质量
三、由质量比
(B的化合价×A的相对原子质量比值)/(A的化合价×B的相对原子质量比值)=A元素的质量比值/B元素的质量比值
正负代化合价数和为零:
【例1】试确定化合物K2MnO4中Mn元素的化合价。 解析:设化合物中Mn元素化合价为+x价,依化合物中各元素化合价正负代数和为零的原则有2×(+1)+1×(+x)+4×(-2)=0解之得x=6 故K2MnO4中Mn元素化合价为+6价。
电子层结构法
【例2】元素X的原子最外层上有1个电子,元素Y的原子最外层上有6个电子,则X、Y两元素可形成的化合物的化学式为[] A.XYB.X2YC.XY2D.X3Y 解析:本题的关键可以说是首先得确定在形成化合物时,X、Y两元素所表现的化合价。因X最外层上只有1个电子,最高正价为+1价,Y最外层6个电子,离8电子稳定结构尚差2个,故最低负价为-2价,则X、Y所形成化合物分子式为X2Y,应选B。
质量分数法
【例3】某元素的相对原子质量为59,在其氧化物中该元素的质量分数为71%,则它的化合价为[] A.+1B.+2C.+3D.+4 解析:设该元素的氧化物化学式为RxOy 依题意有59x/(59x+16y)*100%=71% 解得x/y=2:3 故化学式为R2O3,R化合价为+3价,选C。
质量守恒定律法
【例4】某金属氧化物与足量的盐酸反应,生成的氯化物与水的分子数之比为2∶3,则该金属的化合价是[] A.+1B.+2C.+3D.+4
解析:设生成的氯化物化学式为RClx,依题意有分子数之比RClx∶H2O=2∶3根据质量守恒定律可知,反应前后各元素的原子种类和数目不变,生成物中H、Cl的原子个数比也应为1:1,故x值为3,则R的化合价为+3价,选C。
相对分子质量法
【例5】某金属元素的氧化物相对分子质量为M,同价态的氯化物相对分子质量为N,则该元素的化合价数值为[]
解析:设该元素化合价为+x价,相对原子质量为MR
(1)如x为奇数时,氧化物化学式为R2Ox,氯化物化学式为RClx,据题意有
2MR+16x=M(1)
MR+35.5x=N(2)
(2)*2-(1)得x的值为x=+(2N-M)/55
(2)x为偶数时,氧化物化学式为Rox/2氯化物化学式为RClx,据题意有 MR+35.5x=N(4) x=+(N-M)/27.5
质量关系法
【例6】相对原子质量为M的金属单质ag与足量的稀硫酸反应,产生bg氢气,则反应中该金属元素的化合价为[]
解析:设金属在反应中化合价为+x价,则金属单质与生成H2有如下关系:
2R~xH2
2M 2x
a b
故应选B。
相关因素讨论法
【例7】某元素M原子最外层电子数少于5,其氧化物化学式为MxOy,氯化物化学式MClz当y∶z=1∶2时,M的化合价可能是[]
A.+1B.+2C.+3D.+4
解析:M的化合价在数值上等于z的值
如y=1z=2(合理) y=2z=4(合理) y=3z=6(与最外层电子数少于5不符) 故应选B、D。
金属的化学性质:
常见金属能与氧气反应,也能与盐酸,硫酸及盐溶液反应。
常见金属的化学性质:
1.金属和氧气的反应
2.金属与酸的反应
3.金属与盐的反应
将锌片、铁丝、铜丝三种金属分别放入硫酸铜溶液、硝酸银溶液、氯化钠溶液中,观察现象
易错点:
一、(1)一般在金属活动性顺序表中排在氢前面的金属(也叫活泼金属)能置换出酸中的氢;排在氢后面的金属则不能,如铜、银与盐酸、稀硫酸都不反应。
(2)浓硫酸和硝酸与金属反应不生成氢气,因为它们有很强的氧化性,与金属反应不生成氢气。
(3)在金属活动性顺序表中排在最前面的金属如K、 Na活泼性太强,放入酸溶液中首先跟酸发生置换反应,过M的金属会继续跟水发生剧烈的反应。
(4)铁与非氧化性酸反应时,始终生成亚铁盐 (Fe2+)。
(5)金属与酸反应后溶液的质量增大。
二、
(1)在金属活动性顺序表中,位于前面的金属可以把位于其后面的金属从它们的盐溶液中置换出来(K,Ca,Na除外)。相隔越远,反应越容易发生。
(2)金属与盐溶液的反应,盐必须能溶于水,不溶性的盐与金属不反应,如AgCl难溶于水,Fe和AgCl不反应。
(3)不能用活泼的金属K,Ca,Na,与盐溶液反应,因为K,Ca,Na。会先与H2O发生置换反应生成碱和氢气。
金属与酸的反应不一定属于置换反应:
置换反应是指一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。一般情况下,较活泼的金属跟酸发生的化学反应属于置换反应。但由于浓硫酸(或硝酸)具有强氧化性,金属与浓硫酸(或硝酸)反应时,生成物相对比较复杂。这类反应不属于置换反应。
铝和锌的抗腐蚀性:
1.铝制品具有很好的抗腐蚀性,是因为铝与空气中的氧气反应表面生成一种致密的氧化铝薄膜,对铝起防护作用。
2.锌与铝的抗腐蚀性相似,也是在金属表面会生成一层致密的氧化锌保护膜。
常见金属能与氧气反应,也能与盐酸,硫酸及盐溶液反应。
常见金属的化学性质:
1.金属和氧气的反应
| 金属 | 在空气中 | 在氧气中 | 方程式 |
| 镁 | 常温下表面逐渐变暗。点燃 剧烈燃烧,发出耀眼的白光, 生成白色固体 |
点燃,剧烈燃烧,发出耀 眼的白光,生成白色固体 |
2Mg+O2 2MgO 2MgO |
| 铝 | 常温下,铝表而变暗,生成一 层致密氧化膜,保护铝不再被腐蚀 |
点燃。剧烈燃烧,火星四射, 放出大量的热,生成白色固体 |
4Al+3O2 2Al2O3 2Al2O3 |
| 铁 | 持续加热发红,离火变冷 | 火星四射,放出大量的热, 生成黑色固体 |
3Fe+2O2 Fe3O4 Fe3O4 |
| 铜 | 加热,生成黑色物质,在潮湿的 空气中,生成铜绿而被腐蚀 |
加热,生成黑色固体 | 2Cu+O2 2CuO 2CuO |
| 金 | 即使在高温也不和氧气反应 | —— | |
| 结论 | 大多数金属都能喝氧气反应,但反应的难易程度和剧烈程度不同 | ||
2.金属与酸的反应
| 盐酸 | 稀硫酸 | 反应现象(两种酸中相同) | |
| 镁 | Mg+2HCl==MgCl2+H2↑ | Mg+H2SO4==MgSO4+H2↑ | 反应比较剧烈,产生大量 气泡,溶液仍为无色,生成 的气体能够燃烧,并且产 生淡蓝色火焰 |
| 铝 | 2Al+6HCl==2AlCl3+3H2↑ | 2Al+3H2SO4==Al2(SO4)+3H2↑ | |
| 锌 | Zn+2HCl==H2↑+ZnCl2 | Zn+H2SO4==ZnSO4+H2↑ | 反应缓慢,有气泡产生,溶 液由无色逐渐变为浅绿色, 生成的气体能够燃烧,并且 产生淡蓝色火焰 |
| 铁 | Fe+2HCl==FeCl2+H2↑ | Fe+H2SO4==FeSO4+H2↑ | |
| 铜 | 不反应 | 不反应 | 无 |
3.金属与盐的反应
将锌片、铁丝、铜丝三种金属分别放入硫酸铜溶液、硝酸银溶液、氯化钠溶液中,观察现象
| CuSO4溶液 | AgNO3溶液 | NaCl溶液 | |
| 锌 | 锌表面有一层红色金属析出,溶液由蓝色变为无色 Zn+CuSO4==ZnSO4+Cu |
锌表面有一层银白色金属析出 Zn+2AgNO3==Zn(NO3)2+2Ag |
无变化,不反应 |
| 铁 | 铁表面有一层红色金属析出,溶液由蓝色变为浅绿色 Fe+CuSO4==FeSO4+Cu |
铁表面有一层银白色金属析出,溶液由无色变为浅绿色 Fe+2AgNO3==Fe(NO3)2+2Ag |
无变化,不反应 |
| 铜 | 无变化,不反应 | 铜表面有一层银白色金属析出,溶液由无色变为蓝色 Cu+2AgNO3==Cu(NO3)2+2Ag |
无变化,不反应 |
易错点:
一、(1)一般在金属活动性顺序表中排在氢前面的金属(也叫活泼金属)能置换出酸中的氢;排在氢后面的金属则不能,如铜、银与盐酸、稀硫酸都不反应。
(2)浓硫酸和硝酸与金属反应不生成氢气,因为它们有很强的氧化性,与金属反应不生成氢气。
(3)在金属活动性顺序表中排在最前面的金属如K、 Na活泼性太强,放入酸溶液中首先跟酸发生置换反应,过M的金属会继续跟水发生剧烈的反应。
(4)铁与非氧化性酸反应时,始终生成亚铁盐 (Fe2+)。
(5)金属与酸反应后溶液的质量增大。
二、
(1)在金属活动性顺序表中,位于前面的金属可以把位于其后面的金属从它们的盐溶液中置换出来(K,Ca,Na除外)。相隔越远,反应越容易发生。
(2)金属与盐溶液的反应,盐必须能溶于水,不溶性的盐与金属不反应,如AgCl难溶于水,Fe和AgCl不反应。
(3)不能用活泼的金属K,Ca,Na,与盐溶液反应,因为K,Ca,Na。会先与H2O发生置换反应生成碱和氢气。
金属与酸的反应不一定属于置换反应:
置换反应是指一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。一般情况下,较活泼的金属跟酸发生的化学反应属于置换反应。但由于浓硫酸(或硝酸)具有强氧化性,金属与浓硫酸(或硝酸)反应时,生成物相对比较复杂。这类反应不属于置换反应。
铝和锌的抗腐蚀性:
1.铝制品具有很好的抗腐蚀性,是因为铝与空气中的氧气反应表面生成一种致密的氧化铝薄膜,对铝起防护作用。
2.锌与铝的抗腐蚀性相似,也是在金属表面会生成一层致密的氧化锌保护膜。
发现相似题
与“钠是一种非常活拨的金属,遇空气中的氧或水等物质均会发生化...”考查相似的试题有:
- 写出符合下列要求的化学方程式:(1)用石灰石制生石灰______.(2)泡沫灭火器原理______.(3)有刺激性气味气体生成的化合...
- 下图是二氧化碳的制取和性质实验的微型一体化装置图,该装置的气密性良好.挤压胶头,滴入稀盐酸.______①过一会儿,用燃着的...
- 如图所示的是有关物质的相互转化关系,A、D为红色固体,C为单质,F被认为是最清洁的燃料.请回答:(1)F的化学式为______....
- 氯气(Cl2)是黄绿色气体,水溶液叫氯水.把品红试纸(染有品红的纸)伸入氯水中,品红褪色.发现问题:氯水中的哪些成分能使...
- 下列化学方程式与事实相符的是[ ]A.生石灰放置在空气中质量增加:Ca(OH)2+CO2=CaCO3↓+H2OB.碳酸氢钠治疗胃酸过多:Na2CO3...
- 如图所示下列装置,请根据题目要求,回答下列问题.(1)写出仪器①和②的名称______、______.(2)实验室可用高锰酸钾固体或...
- 某校兴趣小组在我市某地收集到两种岩石样品A和B。他们进行了如下实验探究(B是常用的建筑材料,H是单质,图中部分产物被略去...
- 从热水瓶中倒开水,能够观察到瓶口有白雾,白雾上升一段距离后消失。这一现象无法说明A.分子可分B.分子很小C.分子间有间隔...
- 下列符号中,表示两个氢原子的是A.2H+B.H2C.2HD.2H2
- 研究发现,我国某些地区居民喜欢食用腌制食品,该食品中容易产生一种物质为二甲基亚硝胺,化学式为(CH3)2NNO,它与导致癌症...