本试题 “在如图所示的装置中,烧瓶中盛有空气,广口瓶中盛放下列物质时可发生喷泉的选项是[ ]A.块状大理石和稀硫酸B.NH4Cl与稀NaOH溶液C.Na2O2与NaOH溶液D.铜片与...” 主要考查您对过氧化钠
氢氧化钠
单质铜
铵盐
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 过氧化钠
- 氢氧化钠
- 单质铜
- 铵盐
过氧化钠(Na2O2)的基本性质:
淡黄色固体,较稳定,可用作供氧剂、漂白剂
(1)与水反应:2Na2O2+2H2O==4NaOH+O2↑
(2)与CO2反应:2Na2O2+2CO2==2Na2CO3+ O2
(3)与HCl反应:2Na2O2+4HCl==4NaCl+2H2O+ O2↑
过氧化钠的特性及计算:
1.过氧化钠的强氧化性
2.Na2O2与CO2、H2O(g)反应的重要关系
(1)气体体积差的关系
2Na2O2+2CO2===2Na2CO3+O2 气体体积差 ①
2 1 ΔV=1
2Na2O2+2H2O(g)===4NaOH+O2 气体体积差 ②
2 1 ΔV=1
由此可见,若CO2和水蒸气的混合气体(或单一气体)通过足量Na2O2,气体体积的减少量是原气体体积的1/2,即为生成氧气的量。
(2)先后顺序关系
一定量的Na2O2与一定量的CO2和H2O(g)的混合物反应,可视为Na2O2首先与CO2反应,剩余的Na2O2再与H2O(g)反应。
(3)电子转移关系
当Na2O2与CO2或H2O反应时,每产生1molO2就转移2mol电子。
(4)固体质量变化关系
①足量过氧化钠与水、CO2反应的计算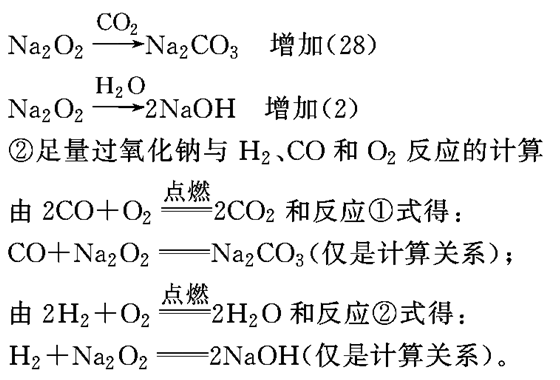
所以,有ag通式符合(CO)m(H2)n(m=0,1,2,3…,n=0,1,2,3…)的物质(包括纯净物和混合物)在氧气中燃烧,将其通过足量过氧化钠,反应完毕后,固体增重ag。
氧化钠与过氧化钠的比较:
| 物质 | 氧化钠 | 过氧化钠 |
| 色态 | 白色固体 | 淡黄色固体 |
| 类别 | 碱性氧化物 |
过氧化物(不属于碱性氧化物) |
| 化学键类型 | 仅含离子键 | 离子键和非极性键 |
| 电子式 | 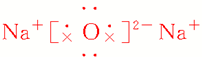 |
 |
| 生成条件 | 常温 | 点燃或加热 |
| 氧的化合价 | -2 | -1 |
| 阴阳离子个数比 | 1:2 | 1:2 |
| 稳定性 | 不稳定 | 稳定 |
| 转化关系 | 2Na2O+O2=2Na2O2 | |
| 用途 | 用于制取少量过氧化钠 | 供氧剂、漂白剂、氧化剂 |
| 与水反应方程式 | 2Na2O+2H2O=2NaOH | 2Na2O2+2H2O=4NaOH+O2↑ |
| 与CO2反应 | Na2O+CO2=NaCO3 | 2Na2O2+2CO2=2Na2CO3+O2↑ |
| 与HCl反应 | Na2O+2HCl=2NaCl+H2O | 2Na2O2+4HCl=4NaCl+2H2O+O2↑ |
| 保存 | 隔绝空气、密封保存 | 隔绝空气、远离易燃物、密封保存 |
特别提醒:
(1)用脱脂棉包裹住过氧化钠,滴加少量水时脱脂棉可以燃烧,不仅可以说明Na2O2与H2O反应生成O2,还可以说明该反应放热。
(2)Na2O2与H2O反应时H2O既不是氧化剂也不是还原剂。
方法技巧:Na2O与Na2O2的结构与性质
(1)Na2O中只含离子键,Na2O2中既含离子键,又含非极性键。
(2)等物质的量的Na2O与Na2O2分别于等量且足量的H2O反应,所得溶液的成分浓度相同
氢氧化钠:
俗称火碱、烧碱、苛性钠
(1)与酸反应:NaOH+HCl==NaCl+H2O、2NaOH+H2SO4==Na2SO4+2H2O
(2)与非金属氧化物反应:2NaOH+CO2==Na2CO3+H2O、2NaOH+SO2==Na2SO3+H2O 、2NaOH+SO3==Na2SO4+H2O、2NaOH+SiO2==Na2SiO3+H2O
(3)与盐反应:2NaOH+CuCl2==Cu(OH)2+2NaCl
氢氧化钠的物理性质:
氢氧化钠为白色半透明,结晶状固体。其水溶液有涩味和滑腻感。密度:2.130g/cm3,熔点:318.4℃,沸点:1390℃。
溶解性:极易溶于水,溶解时放出大量的热。易溶于水醇、乙醇以及甘油。(氢氧化钠具有潮解性)
吸湿性:固碱吸湿性很强,露放在空气中,最后会完全溶解成溶液。
氢氧化钠的化学性质:
强碱性:
氢氧化钠溶液是常见的强碱,具有碱的通性:
①使酸碱指示剂变色:能使石蕊溶液变蓝,能使酚酞溶液变红;
②与酸发生中和反应生成盐和水;NaOH+HCl=NaCl+H2O
③与某些盐反应生成新盐和新碱;2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
④与酸性氧化物反应生成盐和水。2NaOH+CO2====Na2CO3+H2O
腐蚀性:
氢氧化钠对玻璃制品有轻微的腐蚀性,两者会生成硅酸钠,使得玻璃仪器中的活塞黏着于仪器上。如果以玻璃容器长时间盛装热的氢氧化钠溶液,会造成玻璃容器损坏。
氢氧化钠溶液与CO2的反应规律:
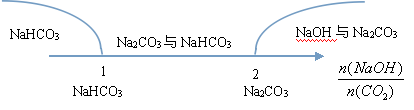
当二氧化碳少量时:2NaOH+CO2(少量)=Na2CO3+H2O
当二氧化碳过量时:Na2CO3+CO2(过量)+H2O=2NaHCO3
当二氧化碳与氢氧化钠的物质的量之比大于1小于2时,生成碳酸钠与碳酸氢钠的混合物。具体各产物的物质的量可根据钠元素守恒和碳元素守恒求算。
铜元素:
在元素周期表中的位置:铜的原子序数29,位于周期表中第四周期,第IB族。
(1)物理性质:有金属光泽,紫红色固体,密度较大,导电导热性能很好,具有很好的延展性,铜属于重金属、有色金属、常见金属,不能被磁铁吸引。
(2)化学性质: 铜常见的化合价为+1价和+2价
①在加热条件下,铜可与多种非金属单质反应。一般来说,遇到氧化性较弱的非金属,铜显较低化合价;遇到氧化性较强的非金属,铜显较高化合价。例如:与强氧化剂反应(如Cl2 Br2等)生成+2价铜的化合物。如:
Cu+Cl2 CuCl2 2Cu+O2
CuCl2 2Cu+O2 2CuO
2CuO
②铜与酸反应:铜只能被氧化性酸中的中心元素氧化。例如: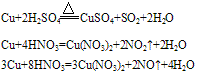
③铜与盐溶液反应:
Cu+2AgCl CuCl2+2Ag
CuCl2+2Ag
铜与铁的对比:
从金属活性顺序表:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au可知,金属铁的金属活性比铜强,所以单质Fe可以从Cu的溶液中还原出单质来,例如: Fe+CuCl2 FeCl2+Cu
FeCl2+Cu
即Fe的还原性强于Cu
铜与浓硫酸和稀硫酸的反应:
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
2Cu+O2+2H2SO4(稀) 2CuSO4+2H2O
2CuSO4+2H2O
注意:从金属活性顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au 可知,铜不能与稀硫酸发生反应,但是在有氧气和加热的条件下可以反应
铜与铜的化合物之间的转换图: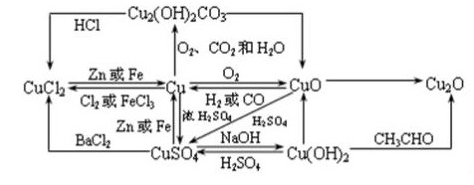
铜的制备和精炼:
(1)工业炼铜法:CuO+CO Cu+CO2
Cu+CO2
(2)湿法炼铜:Fe+CuSO4 FeSO4+Cu
FeSO4+Cu
(3)高温炼铜:工业上用高温冶炼黄铜矿的方法获得铜(粗铜):
2CuFeS2+4O2 Cu2S+3SO2+2FeO(炉渣)
Cu2S+3SO2+2FeO(炉渣)
2Cu2S+3O2 2Cu2O+2SO2
2Cu2O+2SO2
2Cu2O+Cu2S 6Cu+SO2↑
6Cu+SO2↑
备注:粗铜中铜的的含量为99.5%-99.7%,主要含有Ag、Zn、Au等杂质,粗铜通过电解精炼可得到纯度达99.95%-99.98%的铜,原理为用粗铜作阳极,失去电子变为Cu2+,用纯铜棒作阴极即可得精铜。
定义:
铵盐是由铵根离子(NH4+)和酸根离子组成的化合物。铵盐都是晶体,都易溶于水。
铵盐的物理性质和化学性质:
(1)物理性质:铵盐是由铵离子(NH4+)和酸根阴离子组成的化合物,铵盐都是白色晶体,都易溶于水。
(2)铵盐的化学性质:
①受热分解:固态铵盐受热都易分解,根据组成铵盐的酸根阴离子对应的酸的性质的不同,铵盐分解时有以下三种情况:
A. 组成铵盐的酸根阴离子对应的酸是非氧化性的挥发性酸时,则加热时酸与氨气同时挥发,冷却时又重新化合生成铵盐。例如:
 (试管上端又有白色固体附着)。
(试管上端又有白色固体附着)。又如:
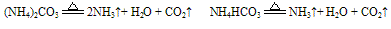
B. 组成铵盐的酸根阴离子对应的酸是难挥发性酸,加热时则只有氨气逸出,酸或酸式盐仍残留在容器中。如:
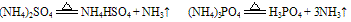
C. 组成铵盐的酸根阴离子对应的酸是氧化性酸,加热时则发生氧化还原反应,无氨气逸出。例如:
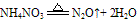
②跟碱反应--铵盐的通性。
固态铵盐+强碱(NaOH、KOH)
 无色、有刺激性气味的气体
无色、有刺激性气味的气体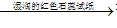 试纸变蓝色。例如:
试纸变蓝色。例如: 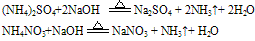
说明:a.若是铵盐溶液与烧碱溶液共热,则可用离子方程式表示为:

b.若反应物为稀溶液且不加热时,则无氨气逸出,用离子方程式表示为:
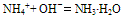
c.若反应物都是固体时,则只能用化学方程式表示。
(3)氮肥的存放和施用.铵盐可用作氮肥.由于铵盐受热易分解,因此在贮存时应密封包装并存放在阴凉通风处;施用氮肥时应埋在土下并及时灌水,以保证肥效。
与“在如图所示的装置中,烧瓶中盛有空气,广口瓶中盛放下列物质...”考查相似的试题有:
- 铷是一种碱金属元素,下列对铷及其化合物性质的推断正确的是 ( )①铷的熔点比钾的高, ②碳酸铷的水溶液呈碱性,③氢氧化铷的...
- 现有碳酸钠和碳酸氢钠的混合物7.4 g,与足量盐酸反应后,生成二氧化碳气体3.3 g。求碳酸钠在混合物中的质量分数。
- 下列俗称表示同一物质的是A.苏打、小苏打B.胆矾、绿矾C.三硝酸甘油酯、硝化甘油D.纯碱、烧碱
- 关于碳酸盐与碳酸氢盐的说法正确的是A.热稳定性:Ca(HCO3)2> CaCO3B.常温时的溶解度:NaHCO3< Na2CO3C.等浓度时溶液的pH:...
- 向含有下列各组离子的溶液中滴加NaOH溶液,得到白色沉淀的是()A.Ba2+HCO-3K+Cl-B.Na+COOH-NOC.Na+OH-SOCOD.Mg2+NO-3Na+Cl-
- 关于金属铯及其化合物的叙述中,正确的是( )A.在无放射性的金属中,铯的熔点最低B.在碱金属的碳酸盐中,碳酸铯最容易分解...
- 将等体积、等pH的NaOH溶液和氨水,分别全部加入到甲、乙烧杯中.下列说法正确的是[ ]A.甲中沉淀一定比乙多B.乙中沉淀一定比...
- 将一定量铁粉和铜粉的混合物加入由稀H2SO4和HNO3组成的混合溶液中,充分反应后金属粉末有剩余,下列有关推断正确的是[ ]A.反...
- 下列说法正确的是[ ]A.高温下,可在试管内完成焦炭和石英砂( SiO2)制取硅的反应B.CO2和钠在一定条件下可以得到金刚石和碳...
- 下列各组物质相互混合后,最终既有气体生成又有沉淀生成的是[ ]①Al投入NaOH溶液 ②Na投入CuSO4溶液 ③Ba(OH)2溶液和(NH4)2CO3...