本试题 “下列分子和离子中中心原子价层电子对几何构型为四面体且分子或离子空间构型为V形的是[ ]A.NH4+B.PH3C.H3O+D.OF2” 主要考查您对价层电子对互斥理论
无机分子的立体结构
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 价层电子对互斥理论
- 无机分子的立体结构
1940年美国的Sidgwick NV等人相继提出了价层电子对互斥理论(valence shell electron pair repulsion theory),简 称VSEPR法,该法适用于主族元素间形成的ABn型分子或离子。该理论认为,一个共价分子或离子中,中心原子A周围所配置的原子B(配位原子)的几何构型,主要决定于中心原子的价电子层中各电子对间的相互排斥作用。这些电子对在中心原子周围按尽可能互相远离的位置排布,以使彼此间的排斥能最小。所谓价层电子对,指的是形成σ键的电子对和孤对电子。孤对电子的存在,增加了电子对间的排斥力,影响了分子中的键角,会改变分子构型的基本类型。根据此理论,只要知道分子或离子中的中心原子上的价层电子对数,就能比较容易而准确地判断ABn型共价分子或离子的空间构型。
确定中心原子中价层电子对数:
中心原子的价层电子数和配体所提供的共用电子数的总和除以2,即为中心原子的价层电子对数。
规定:
①作为配体,卤素原子和H原子提供1个电子,氧族元素的原子不提供电子;
②作为中心原子,卤素原子按提供7个电子计算,氧族元素的原子按提供6个电子计算;
③对于复杂离子,在计算价层电子对数时,还应加上负离子的电荷数或减去正离子的电荷数;
④计算电子对数时,若剩余1个电子,亦当作1对电子处理。
⑤双键、叁键等多重键作为1对电子看待
判断分子的空间构型:
根据中心原子的价层电子对数,从表1中找出相应的价层电子对构型后,再根据价层电子对中的孤对电子数,确定电子对的排布方式和分子的空间构型。
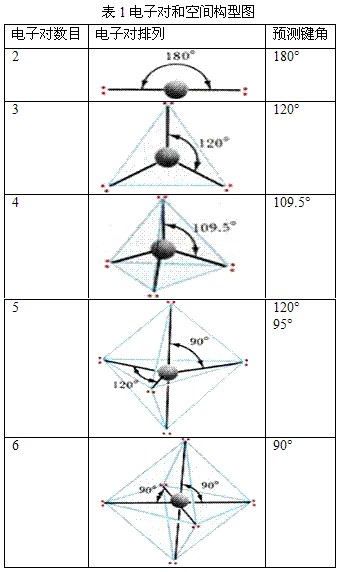
分子中原子的空间关系是分子表现出不同的空间构型。
用价层电子对互斥理论确定分子或离子的VSEPR模型和立体构型的方法:
首先计算分子或离子中的中心原子的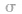 键电子对数和孤电子对数,相加便得到中心原子的价层电子对数。然后由价层电子对的相互排斥,便得到含有孤电子对的VSEPR模型,再略去VSEPR模型中的中心原子的孤电子对,便可得到分子的立体构型。
键电子对数和孤电子对数,相加便得到中心原子的价层电子对数。然后由价层电子对的相互排斥,便得到含有孤电子对的VSEPR模型,再略去VSEPR模型中的中心原子的孤电子对,便可得到分子的立体构型。
1.价层电子对数的确定方法
(1) 键电子对数:由分子式确定,中心原子形成的
键电子对数:由分子式确定,中心原子形成的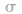 键的数目就是
键的数目就是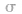 键电子对数。如
键电子对数。如 分子中的中心原子
分子中的中心原子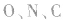 分别有2、3、4对
分别有2、3、4对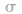 键电子对。
键电子对。
(2)孤电子对数
①分子中的中心原子上的孤电子对数
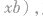 式中a为中心原子的价电子数(主族元素原子的价电子就是最外层电子);x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数 (氢为l,其他原子等于“8一该原子的价电子数”)。
式中a为中心原子的价电子数(主族元素原子的价电子就是最外层电子);x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数 (氢为l,其他原子等于“8一该原子的价电子数”)。
以 为例,a均为6,x分别为2和3,b均为2(氧原子最多能接受的电子数为2),则
为例,a均为6,x分别为2和3,b均为2(氧原子最多能接受的电子数为2),则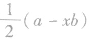 分别为1和0,即SO2的中心原子上的孤电子对数为l, SO3的中心原子上没有孤电子对。
分别为1和0,即SO2的中心原子上的孤电子对数为l, SO3的中心原子上没有孤电子对。
②对于阳离子,a为中心原子的价电子数减去离子的电荷数;对于阴离子,a为中心原子的价电子数加上离子的电荷数(绝对值)。x和b的计算方法及计算公式[中心原子上的孤电子对数= ]均不变。
]均不变。
2.确定分子(或离子)的VSEPR模型
根据价层电子对数和价层电子对的相互排斥,可得出分子或离子的VSEPR模型,其关系如下表。 
3.确定分子(或离子)的立体构型略去VSEPR模型中的中心原子上的孤电子对,便可得到分子或离子的立体构型,如上表。
(1)分子或离子中的价层电子对数分别为2、3、4,则其VSEPR模型分别为直线形、平面三角形、正四面体形或四面体形。如果价层电子对数为5,则为三角双锥形;如果为6,则为正八面体形或八面体形。
(2)如果中心原子的孤电子对数为0,则VSEPR模型(及名称)和分子或离子的立体构型(及名称)是一致的;若孤电子对数不为0,则二者不一致。
与“下列分子和离子中中心原子价层电子对几何构型为四面体且分子...”考查相似的试题有:
- 以下列出了四种物质的分子结构示意图,其中圆圈表示原子核以及包含除价电子以外电子的示意图。黑点表示未形成共价键的最外层...
- (1)基态氮原子的价电子排布式是______.氮气分子中含有一个______键,二个______键.(2)白磷分子的空间构型为______,若...
- 下列说法正确的是A.硼电负性和硅相近B.π键是由两个p电子“头碰头”重叠形成的C.原子和其它原子形成共价键时,其共价键数一定...
- 水结冰是从上向下增厚,而油脂凝固是从下向上进行,对这一现象解释合理的是A.因为水是无机物而油脂是有机物B.因为油脂密度...
- 目前世界各国都在抗击甲型H1N1流感,达菲(Tamiflu)被世界卫生组织推荐作为治疗和预防甲型H1N1流感的有效药物之一,它是以我...
- 下列化学式对应的结构式从成键情况看不合理的是
- (1)氨气易溶于水生成氨水,氨水电离生成铵根离子,铵根离子中氮原子采取________杂化,NH4+中H—N—H键角比NH3中H—N—H键角大,...
- [化学---物质结构与性质]研究物质的微观结构,有助于人们理解物质变化的本质.请回答下列问题.(1)P、S、Cl三种元素中,第...
- 下列说法正确的是A.熔化干冰和熔化NaCl晶体所克服的作用力相同B.氢键比分子间作用力强,所以它属于化学键C.H2O是一种非常...
- 2001年诺贝尔化学奖授予"手性碳原子的催化氢化,氧化反应"研究领域作出贡献的美,日三位科学家,手性分子具有镜像异构及光学...