本试题 “下列叙述中不正确的是( )A.实验室取用金属钠,所需的用品至少有4种B.如果3.9gNa2O2固体中含有m个阴离子,则阿伏加德罗常数的值为20mC.所有金属及其化合...” 主要考查您对阿伏加德罗常数
单质钠
金属的焰色反应
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 阿伏加德罗常数
- 单质钠
- 金属的焰色反应
阿佛加德罗常数:
1mol粒子集体所含离子数与0.012kg碳12中所含的碳原子数相同,约为6.02×1023。
把1mol任何粒子的粒子数叫阿伏加德罗常数。
符号:NA,通常用6.02×1023mol-1表示
阿佛加德罗常数的单位:
阿佛加德罗常数是有单位的量,其单位是:mol-1,需特别注意。
阿佛加德罗常数的正误判断:
关于阿伏加德罗常数(NA)的考查,涉及的知识面广,灵活性强,是高考命题的热点。解答该类题目时要细心审题,特别注意题目中的关键性字词,留心“陷阱”。主要考查点如下:
1.考查“标准状况”、“常温常压”等外界条件的应用
(1)在标准状况下非气态物质:如H2O、SO3、戊烷、CHCl3、CCl4、苯、乙醇等,体积为22.4L时,其分子数不等于NA。
(2)注意给出气体体积是否在标准状况下:如11.2LH2的分子数未必是0.5NA。
(3)物质的质量、摩尔质量、微粒个数不受外界条件的影响。
2.考查物质的组成
(1)特殊物质中所含微粒(分子、原子、电子、质子、中子等)的数目:如Ne、D2O、18O2、H37Cl、—OH等。
(2)某些物质的阴阳离子个数比:如NaHSO4晶体中阴、阳离子个数比为1∶1,Na2CO3晶体中阴、阳离子个数比为1∶2。
(3)物质中所含化学键的数目:如H2O2、CnH2n+2中化学键的数目分别为3、3n+1。
(4)最简式相同的物质中的微粒数目:如NO2和N2O4,乙烯和丙烯等。
3.考察氧化还原反应中电子转移的数目
如:Na2O2、NO2与H2O的反应;Cl2与H2O、NaOH溶液、Cu或Fe的反应;电解AgNO3溶液、NaCl溶液等。
4.考查弱电解质的电离及盐的水解
如1L0.1mol/L的乙酸溶液和1L0.1mol/L的乙酸钠溶液中的CH3COO-的数目不相等且都小于0.1NA;1L0.1mol/L的NH4NO3溶液中c(NH4+)<0.1mol/L,但含氮原子总数仍为0.2NA;1molFeCl3水解生成Fe(OH)3胶粒的数目远远小于NA。
5.考查一些特殊的反应
如, 1molN2与3H2反应实际生产中得不到2molNH3,因是可逆反应;标准状况下2.24LO2和2.24LNO混合后,由于发生:2NO+O2==2NO2和
1molN2与3H2反应实际生产中得不到2molNH3,因是可逆反应;标准状况下2.24LO2和2.24LNO混合后,由于发生:2NO+O2==2NO2和![]() 两个反应,使2.24L<V<3.36L。
两个反应,使2.24L<V<3.36L。
有关NA的问题中常见的几种特殊情况:
有关NA的问题分析中易忽视如下问题而导致错误:
(1)碳原子超过4个的烃类物质、标准状况下的SO3等均不是气体,不能使用“22.4L/mol”来讨论问题。
(2)Na2O2由Na+和O22-构成,而不是由Na+和O2-构成,阴阳离子个数比为1:2而不是1:1.
(3)SiO2结构中只有原子无分子,1molSiO2中含有共价键数为4NA
钠的基本性质:
钠元素的原子序数等于11,在周期表中位于第三周期,第ⅠA族。钠的原子结构示意图为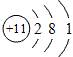 ,故钠的金属性比较强,是很活泼的金属材料。其单质很软,具有银白色金属光泽,是热和电的良导体。钠的密度比水小,比煤油大,熔点97.81℃,沸点882.9℃。
,故钠的金属性比较强,是很活泼的金属材料。其单质很软,具有银白色金属光泽,是热和电的良导体。钠的密度比水小,比煤油大,熔点97.81℃,沸点882.9℃。
钠的物理性质:
钠单质很软,具有银白色金属光泽,是热和电的良导体。钠的密度比水小,比煤油大,熔点97.81℃,沸点882.9℃。
概括为:银白软轻低,热电良导体。
钠的化学性质:
钠的原子结构示意图为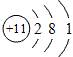 。
。
①与非金属单质的反应
A. 与氧气反应 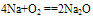 (白色固体,不稳定)(空气中,钠的切面由银白色逐渐变暗的原因)
(白色固体,不稳定)(空气中,钠的切面由银白色逐渐变暗的原因)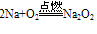 (淡黄色固体,较稳定)
(淡黄色固体,较稳定)
B. 与硫反应
2Na + S ==Na2S (研磨时发生爆炸)
C. 与氯气反应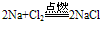
②与水反应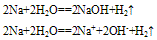
| 主要实验现象 | 对实验现象的分析 |
| 浮在水面上 | 密度比水小 |
| 熔化成闪亮的小球 | 反应放热,且钠的熔点低 |
| 迅速游动 | 反应产生气体(H2) |
| 嘶嘶作响 | 反应剧烈 |
| 溶液呈红色 | 反应生成NaOH,遇酚酞变红 |
③与盐溶液反应
钠与盐溶液反应,先考虑钠与水反应生成氢氧化钠,在考虑氢氧化钠是否与盐反应。
A. 投入NaCl溶液中,只有氢气放出。2Na+2H2O==2NaOH+H2↑
B. 投入饱和NaCl溶液中,有氢气放出,还有NaCl晶体析出(温度不变)。
C. 投入NH4Cl溶液中,有H2和NH3逸出。2Na+2NH4Cl==2NaCl+2NH3↑+H2↑
D. 投入CuSO4溶液中,有气体放出和蓝色沉淀生成。
2Na+2H2O+CuSO4==Na2SO4+Cu(OH)2↓+H2↑
如何正确取用钠?
钠具有很活泼的化学性质,易与很多物质反应,所以在取用钠时一定要注意,千万不能直接用手去拿,以免手被腐蚀,实验剩余的钠屑,绝对不可以随意丢弃,而应放回到原瓶中。
正确做法:用镊子取一小块金属钠,用滤纸吸干表面的煤油,用小刀切去一端的表层,观察表面的颜色。实验中剩余的钠必须放回原瓶。
钠露置在空气中的一系列变化:
Na→Na2O→NaOH→Na2CO3→Na2CO3·10H2O→Na2CO3
钠的保存、制取及用途 :
①保存:由于金属钠的化学性质非常活泼,易与空气中的氧气、水蒸气反应,所以钠要保存在煤油中。
②在实验室中钠块的取用:用镊子从试剂瓶中取出钠块,用滤纸吸净表面上的煤油,在玻璃片上用小刀切去表面的氧化层,再切下一小粒备用,余下的钠全部放回试剂瓶中。
③制取:
④用途:
A. 工业上用Na作还原剂,用与冶炼金属,如4Na+TiCl4 Ti+4NaCl
Ti+4NaCl
B. Na-K合金(液态)用作原子反应堆的导热剂。
C. 在电光源上,用钠制造高压钠灯。
焰色反应:
焰色反应是化学上用来测试某种金属是否存在在化合物的方法。其原理是每种元素都有其特别的光谱,显示出不同的颜色。
焰色反应的操作:
先准备一支铂丝,钴蓝玻璃及盐或其溶液。
把铂丝浸在浓盐酸中以清除先前余下的物质,再把铂丝放在酒精灯焰(蓝色火焰)中直至没有颜色的变化。
用蒸馏水或去离子水或纯水冲洗铂丝。
用铂丝接触盐或溶液,通过酒精灯焰(蓝色火焰)中加热。
当钠离子存在于所测试的溶液中,用钴蓝玻璃过滤钠离子的焰色。
最后将观察焰色。钠的焰色为明亮的金黄色火焰。
各种元素的颜色:
| 元素符号 | 离子元素 | 名称 | 焰色 |
| Ba | Ba2+ | 钡 | 黄绿 |
| Ca | Ca2+ | 钙 | 砖红 |
| Cs | Cs+ | 铯 | 浅紫 |
| Na | Na+ | 钠 | 黄 |
| Zn | Zn2+ | 锌 | 蓝绿 |
| Fe(III) | Fe3+ | 铁(III) | 金黄 |
| K | K+ | 钾 | 浅紫(透过蓝色钴玻璃) |
| Li | Li+ | 锂 | 深红 |
碱金属元素的性质:
1.氧化产物的特殊性。碱金属在空气中燃烧,只有Li氧化生成Li2O;其余的生成过氧化物(如Na2O2)或更复杂的氧化物(如KO2)。
2.碱金属单质密度都较小,其中锂的密度是所有金属中最小的。
3.碱金属单质熔点都较低,只有Li的熔点高于100℃。
4.钾、钠在常温下为固态,但钾钠合金在常温下为液态,可作为原子反应堆的导热剂。
5.碱金属单质通常保存在煤油中,但因锂的密度小于煤油而只能保存在液体石蜡中或封存在固体石蜡中。
6.一般说,酸式盐较正盐溶解度大,但NaHCO3却比Na2CO3溶解度小。
7.试剂瓶中的药品取出后,一般不能放回原瓶,但ⅠA族金属Na、K等除外。
8.一般活泼金属能从盐中置换出不活泼金属,但非常活泼的金属Na、K等除外。
9.Fr是放射性元素,所以在自然界中不存在。
(1)有些金属或它们的化合物在灼烧时会使火焰呈现出特色的颜色的想象。
(2)操作:
①洗:用盐酸洗去铂丝表面的杂质
②烧:将铂丝在酒精灯火焰上灼烧至于酒精灯颜色一致
③蘸:蘸取试样
④烧:在火焰上灼烧
⑤观:观察火焰颜色(若检验钾要透过钴玻璃观察)
(3)常见的颜色反应
Li Na K Ca Sr Ba Cu
紫红 黄 紫(透过蓝色钴玻璃片) 砖红 洋红 黄绿 绿
①焰色反应为物理变化过程。
②焰色现象与金属元素的存在有关,与物质组成无关。如:钠元素的焰色为黄色,包括钠单质以及钠的所有化合物。
与“下列叙述中不正确的是( )A.实验室取用金属钠,所需的用品...”考查相似的试题有:
- 设NA为阿伏加德罗常数,下列说法不正确的是[ ]A.标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NAB.18g水中含有的...
- 下列叙述完全正确的一组是( )①一定条件下,气体的摩尔体积为11.2L②标准状况下,将mlg锌加入到m2g 20%的盐酸中放出nLH2,则...
- 下列说法正确的是[ ]A.对于平衡体系:,其它条件不变时,增大体系压强,平衡向正反应方向移动,体系颜色加深B.常温下pH=4...
- 科学家刚刚发现了某种元素的原子,其质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是( )①该原子...
- 设NA代表阿伏加德罗常数的数值。下列有关叙述正确的是[ ]A.标准状况下,2.24LSO3含有的分子数等于0.1NAB.1 mol CaC2所含阴离...
- 用NA表示阿伏加德罗常数.下列说法错误的是( )A.1mol钠作为还原剂可提供的电子数为NAB.16g氧气中所含的氧原子数为NAC.18...
- 下列解释事实的方程式不准确的是A.铝热法炼铁:Fe2O3+ 2Al高温Al2O3+ 2FeB.工业上用NH3制备NO:4NH3+ 5O24NO + 6H2OC.向受...
- 钠与水反应的现象和钠的下列性质无关的是( )A.钠的熔点较低B.钠的密度小于水C.钠的硬度较小D.钠的还原性强
- 将1.15 g钠和0.4 g硫粉迅速混合,并放在石棉网上加热,反应后的固体可能是( )A.硫与硫化钠B.氧化钠与硫化钠C.过氧化钠与...
- 下列说法中正确的是( )A.用光亮洁净的铁丝蘸取某无色溶液,在无色灯焰上灼烧时观察到黄色火焰,则该溶液中一定含Na+,一定...