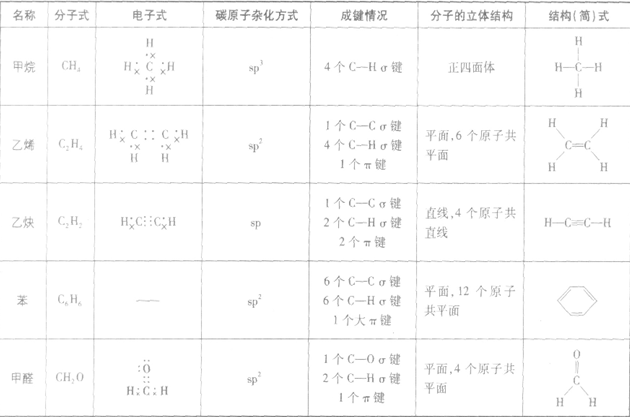
本试题 “居室是我们日常生活中最重要的场所.现代入在“煤烟型”、“光化学烟雾”污染后,正在进入以“室内空气污染”为标志的第三污染时期.造成室内环境污染的有毒物质主...” 主要考查您对电子式的书写
结构式
酸碱中和滴定
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电子式的书写
- 结构式
- 酸碱中和滴定
定义:
在化学反应中,一般是原子的最外层电子数目发生变化。为了简便起见,化学中常在元素符号周围用小黑点“· ”或小叉“×”来表示元素原子的最外层电子,相应的式子叫做电子式。
(1)原子的电子式:H· 、Na· 、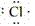
(2)阳离子的电子式:不画出离子最外层电子数,元素右上角标出“n+”电荷字样:Na+、Al3+、Mg2+
(3)阴离子的电子式:要画出最外层电子数,用 “[ ]”括起来,右上角标出“n-”: 、
、 、
、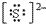
(4)离子化合物的电子式:由阴、阳离子的电子式组成,相同离子不能合并: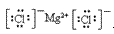 、
、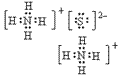
(5)共价化合物的电子式:画出离子最外层电子数: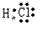 、
、
(6)用电子式表示物质形成的过程:
氯化氢的形成过程: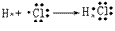
氯化镁的形成过程: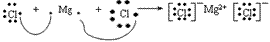
结构式:
共价键中的每一对共用电子用一根短线表示,未成键电子不写出,物质的电子式就变成了结构式。
例如: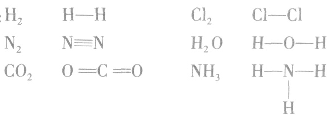
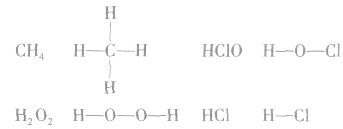
书写电子式的常见错误:
1.漏写未参与成键的电子,如: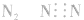
2.化合物类型不清,漏写或多写“[]”及错写电荷数,如: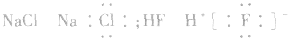
3.书写不规范,错写共用电子对如:N2的电子式为: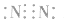 ,不能写成:
,不能写成: ,更不能写成:
,更不能写成: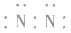 或
或 。
。
4.不考虑原子间的结合顺序如:HClO的电子式为 ,而非
,而非 。因氧原子需形成2对共用电子才能达到稳定结构,而H、 Cl各需形成1对共用电子就能达到稳定结构。
。因氧原子需形成2对共用电子才能达到稳定结构,而H、 Cl各需形成1对共用电子就能达到稳定结构。
5.不考虑原子最外层有几个电子均写成8电子结构如: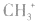 的电子式为
的电子式为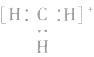 ,而非
,而非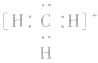 , 因
, 因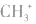 中碳原子最外层应有6个电子(包括共用电子),而非8个电子。
中碳原子最外层应有6个电子(包括共用电子),而非8个电子。
6.不清楚A如型离子化合物中两个B是分开写还是写一块如: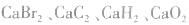 中
中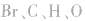 均为-l 价,Br-、H-已达到稳定结构,应分开写;C原子得一个电子,最外层有5个电子,需形成三对共用电子才能达到稳定结构,不能分开写;氧原子得一个电子,最外层有7个电子,需形成一对共用电子才能达到稳定结构,也不能分开写。它们的电子式分别为:
均为-l 价,Br-、H-已达到稳定结构,应分开写;C原子得一个电子,最外层有5个电子,需形成三对共用电子才能达到稳定结构,不能分开写;氧原子得一个电子,最外层有7个电子,需形成一对共用电子才能达到稳定结构,也不能分开写。它们的电子式分别为: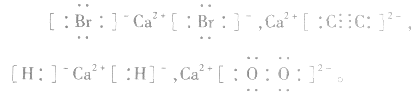
表示分子的结合或排列顺序的式子;如:
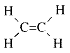
有机物分子中原子共直线、共平面问题的判断:
1、分子空间结构的基本类型:
2、分子中原子共线、共面情况的判断方法:
以上述分子结构为原型和思维起点,把复杂的有机物分子分解成几个部分,借助单键可以旋转、双键和三键不能旋转这一知识来分析所分解的各个部分,再予以综合,便能得出分子中在同一平面或同一直线上的原子数目。例如:分子中只要有碳原子形成4个单键,则所有原子小可能都在一个平面上, 中最多有6个原子(5个C原子、1个H原子)在同一条直线上,最多有15个原子(除一CH3上的2个氢原子外)在同一平面上。
中最多有6个原子(5个C原子、1个H原子)在同一条直线上,最多有15个原子(除一CH3上的2个氢原子外)在同一平面上。
酸碱中和滴定:
用已知物质的量浓度的酸(或碱)来测 定未知物质的量浓度的碱(或酸)的方法叫做酸碱中和滴定。
(1)原理:对于一元酸和一元碱发生的中和反应,C酸V酸=C碱V碱 或:C未知V未知=C标准V标准,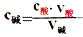
(2)仪器:a.酸式滴定管 b.碱式滴定管c.铁架台d.滴定管夹e.锥形瓶 f.烧杯g.胶头滴管等
(3)装置图: 
(4)操作步骤:
洗涤、检漏、水洗、润洗、装液、去泡、调液面记录、放待测液、加指示剂、滴定、记录、
计算、误差分析
(5)数据处理依据:
c(NaOH)=c(HCl)V(HCl)/V(NaOH)
(6)误差分析:
①仪器润洗不当:
a.盛标准液的滴定管用蒸馏水洗后未用标准液润洗;
b.盛待测液滴定(移液)管用蒸馏水洗后未用待测液润洗;
c.锥形瓶用蒸馏水洗后再用待测液润洗;
②读数方法有误:
a.滴定前仰视,滴定后俯视;
b.滴定前俯视,滴定后仰视;
c.天平或量筒的使用读数方法错误;
③操作出现问题:
a.盛标准液的滴定管漏液;
b.盛待测液的滴定管滴前尖嘴部分有气泡,终了无气泡
(或前无后有);
c.振荡锥形瓶时,不小心有待测液溅出;
d.滴定过程中,将标准液滴到锥形瓶外;
中和滴定中的误差分析:
中和滴定是一个要求较高的定量实验,每一个不当的或错误的操作都会引起误差。
对于一元酸与一元碱,由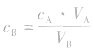 可知,
可知,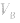 是准 确量取的体积,
是准 确量取的体积, 是标准溶液的浓度,它们均为定值,所以
是标准溶液的浓度,它们均为定值,所以 的大小取决于
的大小取决于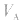 的大小,
的大小,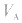 大则
大则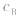 大,
大, 小则
小则 小。
小。
以标准酸溶液滴定末知浓度的碱溶液(酚酞作指示剂)为例,常见的不正确操作对实验结果的影响见下表: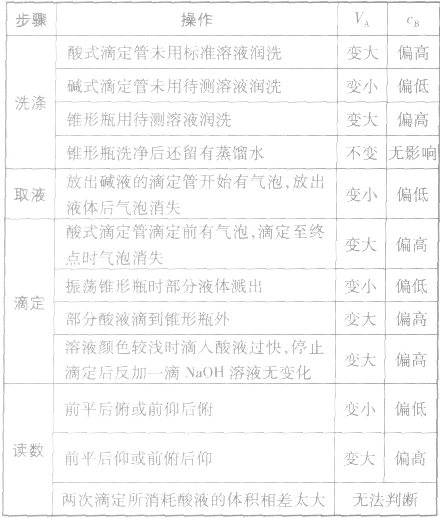
中和滴定应注意的问题:
1.中和滴定中指示剂的使用与选择
(1)用量不能太多,常用2~3滴,冈指示剂本身也是有机弱酸或有机弱碱,若用量太多,会使中和滴定中需要的酸或碱的量增多或减少。
(2)指示剂的选择:中和滴定时一般选用的指示剂有酚酞和甲基橙。石蕊试液由于颜色变化不明显,不易辨别,在滴定过程中不宜使用。
(3)酸、碱恰好完全反应时,终点溶液的pH应在指示剂的变色范围内,如强酸溶液滴定弱碱溶液应选用甲基橙作指示剂;强碱溶液滴定弱酸溶液应选用酚酞作指示剂。
(4)指示剂的变色:最好由浅到深,这样对比明显。如用强碱滴定强酸用酚酞作指示剂较好,当酚酞从无色变为粉红色(或浅红色)且半分钟内不褪色时即达到滴定终点。
2.欲减小实验误差的三点做法
(1)半分钟:振荡,半分钟内颜色不褪去,即为滴定终点。
(2)l一2min:滴定停止后,必须等待l~2min,让附着在滴定管内壁的溶液流下后,再进行读数。
(3)重复:同一实验,要做两到三次,两次滴定所用标准溶液的体积的差值不能超过0.02mL,再取平均值。
与“居室是我们日常生活中最重要的场所.现代入在“煤烟型”、“光化...”考查相似的试题有:
- 在元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的 A、B、C、D四种元素,它们的原子最外层电子数依...
- 某主族元素R的原子其电子式可用下式表示:。该元素组成的以下物质,其分子式肯定错误的是[ ]A.最高价氧化物分子式为R2O5B....
- 下列化学名词正确的是( )A.三溴笨酚B.烧碱C.乙酸乙脂D.石碳酸
- 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是( )A...
- 为测定某有机物的结构,用核磁共振仪处理后得到如图所示的核磁共振氢谱,则该有机物可能是( )A.B.C.C2H5OHD.
- 下列物质在通常条件下能与氢氧化钠溶液反应的是( )A.甲烷B.乙醇C.苯D.乙酸
- 下列各组物质不属于同分异构体的是( )A.2-甲基-2-丁烯和环戊烷B.2-甲基-1,3-丁二烯和1-戊炔C.2-丁醇和2-甲基-...
- 某有机物A的结构简式如图,下列有关A的说法正确的是 ( )A.分子式为:C14H15O6NBrB.该分子中含有两个手性碳原子C.不能使酸...
- 手性分子是指在分子结构中,当a、b、c、d为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。下...
- 下列说法中,不正确的是 ( )A.石油、天然气、可燃冰、植物油都属于化石燃料B.丙烯既能使溴的四氯化碳溶液褪色,又能在光...