本试题 “二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成(S2Cl2),某化学研究性学习小组查阅了有关资料,得到如下信息:①将干燥的氯气在110℃~140℃与硫...” 主要考查您对氯的其他化合物(高氯酸、氯化物、氯酸盐,盐酸等)
其他物质的制备(硫酸铜晶体、铁红等)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氯的其他化合物(高氯酸、氯化物、氯酸盐,盐酸等)
- 其他物质的制备(硫酸铜晶体、铁红等)
常见的氯化物:
(1)高氯酸:高氯酸HClO4,无色透明的发烟液体,在无机酸中酸性最强。可助燃,具强腐蚀性、强刺激性,可致人体灼伤。与有机物、还原剂、易燃物如硫、磷等接触或混合时有引起燃烧爆炸的危险。在室温下分解,加热则爆炸。
(2)氯化物:如氯化钠、氯化钙等,Cl-+Ag+==AgCl↓
(3)次氯酸盐:次氯酸盐是次氯酸的盐,含有次氯酸根离子ClO-,其中氯的氧化态为+1。次氯酸盐常以溶液态存在,不稳定,会发生歧化反应生成氯酸盐和氯化物。见光分解为氯化物和氧气。次氯酸盐是一种常用的漂白剂和消毒剂。在人体组织中,在亚铁血红素的髓过氧化物酶的催化作用下,过氧化物与氯化物反应可产生ClO-或HClO。这种在血球内产生的ClO-/HClO或Cl2
(4)氯酸盐:如氯酸钾在二氧化锰催化下可制取氧气
(5)盐酸:盐酸是氯化氢的水溶液,是一种混合物。纯净的盐酸是无色的液体,有刺激性气味。工业品浓盐酸因含有杂质(Fe3+)带有黄色。浓盐酸具有挥发性,打开浓盐酸的瓶盖在瓶口立即产生白色酸雾。这是因为从浓盐酸中挥发出来的氯化氢气体跟空气中水蒸汽接触,形成盐酸小液滴分散在空气中形成酸雾。
(6)氯化氢:无色或微黄色易挥发性液体,有刺鼻的气味。易溶于水与氨气反应生成氯化铵HCl+NH3==NH4Cl
卤化氢和氢卤酸、卤化银及碘化物:
1.卤化氢物理性质:卤化氢均为无色有刺激性气味的气体,均极易溶于水,在空气中都易形成酸雾。化学性质:从HF—HCl—HBr—HI,稳定性逐渐减弱,HI受热易分解;还原性逐渐增强。
2.氢卤酸:Hx溶于水后形成的溶液即氢卤酸。在氢卤酸中,除氢氟酸是弱酸外,其余皆为强酸。从氢氟酸一氢碘酸,酸性逐渐增强,还原性也逐渐增强,其中氢碘酸在空气中易被氧气氧化。
3.卤化银:

4.碘化物碘是人体必需的微量元素之一,又称“智慧元素”。人体缺碘会导致碘缺乏病(IDD),从而损害人的智力和健康。补碘最经济、方便有效的方法是食用含碘食盐。含碘食盐中加的是碘酸钾。值得注意的是,人体摄入过多的碘也是有害的,不能认为高碘的食物吃得越多越好,要根据个人的身体情况而定。
卤素单质及其化合物的特殊性:
(1)Br2是常温下唯一呈液态的非金属单质,易挥发,蒸气有毒。保存液溴要采用水封法。
(2)碘单质易升华,AgI可用于人工降雨,碘盐可用于防治甲状腺肿大。
(3)HClO4是常见含氧酸中酸性最强的酸,HClO 是氯的含氧酸中氧化性最强的酸。
(4)在卤素中,氯、溴、碘均有多种价态,但氟只有-1价和0价,而无正价。
(5)卤素单质一般不与稀有气体反应,但F,却能与Xe、Kr等稀有气体反应生成相应的氟化物。如 KrF2、XeF2、:XeF4、XeF6等。
(6)Cl2、Br2、I2的实验室制法均可用MnO2与相应的浓的氢卤酸反应制得,但F2不能用上述方法在实验室制得。
(7)卤素单质与水反应,其中Cl2、Br2、I2在反应中既是氧化剂又是还原剂,而F2与水作用时,只作氧化剂。
(8)卤素单质都能与强碱溶液反应,一般可表示为 X2+2OH-==X-+XO-+H2O(F、I除外)。
(9)碘单质遇淀粉呈现特殊蓝色。可用来鉴别碘单质或淀粉。
(10)I2在水中的溶解度很小,若在水中加入少量的KI,碘的溶解度却明显增大,这是因为发生了反应I2 +I-==I3-
(11)卤素单质与Fe作用时,除Fe+I2==FeI2 外,其他均生成+3价铁盐。常温下,干燥的液氯不与 Fe作用,故工业上可用钢瓶盛液氯。
(12)随着相对分子质量的增大,HCl、HBr、HI的熔、沸点逐渐升高。HF的相对分子质量虽比HCl小,其熔、沸点却比HCl高,是因为HF分子间存在氢键。
(13)在氧卤酸中,只有氢氟酸能与玻璃反应:SiO2 +4HF==SiF4↑+2H2O,在实验室制取HF必须在铅皿中进行。
(14)实验室制取HF、HCl分别用CaF2、NaCl与浓硫酸反应,但实验室制取HBr、HI宜用NaBr和KI与浓磷酸反应。因为生成的HBr、HI易被浓硫酸氧化生成Br2或I2。
(15)在卤化银中,AgCl、AgBr、AgI均难溶于水,且见光易分解,但AgF却易溶于水且见光不分解。
(1)反应原理:CH3COONa+NaOH
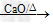 CH4+Na2CO3
CH4+Na2CO3(2)发生装置:固+固
 气
气 (3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法/向下排空气法
(5)尾气处理:无
(6)检验方法:①点燃,淡蓝色火焰,燃烧产物是H2O和CO2
实验室制取一氧化氮(NO):
(1)反应原理:3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法
(5)尾气处理:收集法(塑料袋)
(6)检验方法:无色气体,暴露于空气中立即变为红棕色
实验室制取二氧化氮(NO2):
(1)反应原理:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:碱液吸收 (3NO2+H2O==2HNO3+NO;NO+NO2+2NaOH===2NaNO2+H2O)
实验室制取氯化氢(HCl):
(1)反应原理:2NaCl+H2SO4
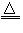 Na2SO4+2HCl?
Na2SO4+2HCl?(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:水(防倒吸装置)
(6)检验方法:①能使湿润的蓝色石蕊试纸变红 ②靠近浓氨水冒白烟
五水硫酸铜的制备:
(1)实验原理:铜是不活泼金属,不能直接和稀硫酸发生反应制备硫酸铜,必须加入氧化剂。在浓硝酸和稀硫酸的混合液中,浓硝酸将铜氧化成Cu2+,Cu2+与SO42-结合得到硫酸铜: Cu+2HNO3+H2SO4====CuSO4+2NO2+2H2O 未反应的铜屑(不溶性杂质)用倾滗法除去。利用硝酸铜的溶解度在0~100℃范围内均大于硫酸铜溶解度的性质,溶液经蒸发浓缩析出硫酸铜,经过滤与可溶性杂质硝酸铜分离,得到粗产品。硫酸铜的溶解度随温度升高而增大,可用重结晶法提纯。在粗产品硫酸铜中,加适量水,加热成饱和溶液,趁热过滤除去不溶性杂质。滤液冷却,析出硫酸铜,过滤,与可溶性杂质分离,得到纯的硫酸铜。
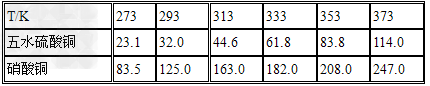
(2)实验步骤
①称量1.5g铜屑,灼烧至表面呈现黑色,冷却;
②加5.5mL3mol/L硫酸,2.5mL浓硝酸,反应平稳后水浴加热,补加2.5mL3mol/L硫酸,0.5mL浓硝酸;
③铜近于完全溶解后,趁热倾滗法分离;
④水浴加热,蒸发浓缩至结晶膜出现;
⑤冷却、过滤;
⑥粗产品以1.2mL水/g的比例,加热溶于水,趁热过滤;
⑦滤液冷却、过滤、晾干,得到纯净的硫酸铜晶体。
⑧称重,计算产率。
实验室制取硫化氢(H2S):
(1)反应原理:FeS+2HCl→H2S↑+FeCl2
(2)发生装置:固+液→气(启普发生器)
(3)净化方法:饱和NaHS(除HCl),固体CaCl2(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:CuSO4溶液或碱液吸收(H2S+2NaOH==Na2S+H2O或H2S+NaOH==NaHS+H2O)
(6)检验方法:①湿润的蓝色石蕊试纸变红 ②湿润的醋酸试纸黑
与“二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成...”考查相似的试题有:
- (15分)某化学兴趣小组利用以下各装置连接成一整套装置,探究氯气与氨气之间的反应.其中D为纯净干燥的氯气与纯净干燥氨气反应...
- 含下列某种杂质的氯化钠样品,经测定氯的质量分数为62.0%,则该样品中含有的杂质可能是A.MgCl2B.ZnCl2C.BaCl2D.KCl
- 潮湿的Cl2,新制的氯水,次氯酸能使有色布条褪色,其原因是这些物质中含有( )A.HClB.Ca(ClO)2C.Cl2D.HclO
- (4分)(1)写出下列物质的化学式:①漂白粉的有效成分: ;②钡餐: 。(2)写出用Na2SO3与浓H2SO4反应制备SO2的化学方程式: 。
- (12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题...
- 高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取:NaClO4(aq)+NH4Cl(aq)NH4ClO4(aq)+NaCl(aq)(1)...
- 用分液漏斗和烧杯可以装配成一套简易的,能随开随用、随关随停的气体发生装置,如图所示。能用此装置制备的气体有[ ]A. 用块...
- 下图中a、b表示相应仪器中加入的试剂,可用下图装置制取、收集的气体是
- 阅读以下材料,回答相关问题。【材料】实验室制备N2通常有下列三种方案:方案1:加热条件下,以NH3还原CuO制得N2,同时获得活...
- (12分)右图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制100 mL 1 mol·L-1的稀硫酸...