本试题 “2L容积不变的密闭容器中,加入1.0molA和2.2molB,进行如下反应:A(g)+2B(g)⇌C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图试回答下...” 主要考查您对达到化学平衡的标志
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 达到化学平衡的标志
化学平衡移动的含义:
1.当一个可逆反应达到平衡状态后,如果改变温度、压强、浓度等反应条件.原来的平衡状态会被破坏,化学平衡会发生移动,平衡混合物中各组成物质的质量分数也就随着改变,在一段时间后达到新的平衡状态,这种由原平衡状态向新平衡状态的变化过程。就是化学平衡的移动。以上过程可归纳如下:

2.化学平衡移动与化学反应速率的关系
当与化学平衡体系有天的外界条件改变以后,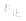 >
>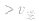 ,化学平衡向正反应方向移动;
,化学平衡向正反应方向移动; ,化学平衡不移动;
,化学平衡不移动;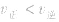 ,化学平衡向逆反应方向移动。
,化学平衡向逆反应方向移动。
化学平衡状态:
(1)定义:在一定条件下的可逆反应中,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态,叫做化学平衡状态,简称化学平衡。
(2)化学平衡的建立对于可逆反应,不管从正反应开始(只投入反应物),还是从逆反应开始(只投入生成物),或从正、逆反应同时开始(同时投入反应物和生成物),在一定条件下都会达到 的状态。当
的状态。当 相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。
相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。
化学平衡的特征:
(1)逆:只有可逆反应才能达到化学平衡状态。
(2)动:是动态平衡,正、逆反应仍在不断进行。
(3)等: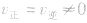 。
。
(4)定:各组分的浓度及百分含量保持一定。
(5)变:当影响化学平衡的外界条件发生变化使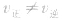 时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
化学平衡状态的判断:
1.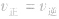 指的是同一物质的正反应速率与逆反应速率相等。
指的是同一物质的正反应速率与逆反应速率相等。
2.反应混合物中各组分的含量(质量分数、体积分数、物质的量分数)保持不变。
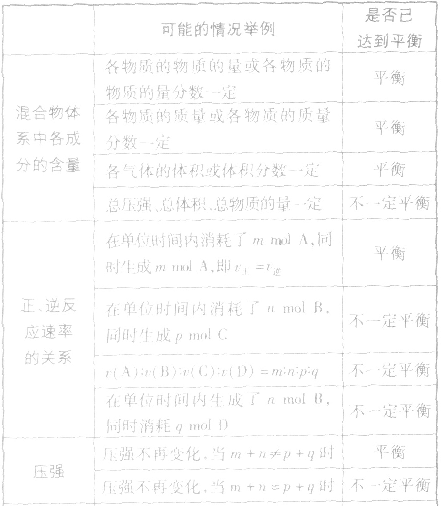
3.反应类型分析对于密闭容器中的反应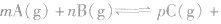 qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。
qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。

1.当一个可逆反应达到平衡状态后,如果改变温度、压强、浓度等反应条件.原来的平衡状态会被破坏,化学平衡会发生移动,平衡混合物中各组成物质的质量分数也就随着改变,在一段时间后达到新的平衡状态,这种由原平衡状态向新平衡状态的变化过程。就是化学平衡的移动。以上过程可归纳如下:

2.化学平衡移动与化学反应速率的关系
当与化学平衡体系有天的外界条件改变以后,
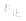 >
>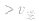 ,化学平衡向正反应方向移动;
,化学平衡向正反应方向移动; ,化学平衡不移动;
,化学平衡不移动;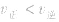 ,化学平衡向逆反应方向移动。
,化学平衡向逆反应方向移动。化学平衡状态:
(1)定义:在一定条件下的可逆反应中,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态,叫做化学平衡状态,简称化学平衡。
(2)化学平衡的建立对于可逆反应,不管从正反应开始(只投入反应物),还是从逆反应开始(只投入生成物),或从正、逆反应同时开始(同时投入反应物和生成物),在一定条件下都会达到
 的状态。当
的状态。当 相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。
相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。 化学平衡的特征:
(1)逆:只有可逆反应才能达到化学平衡状态。
(2)动:是动态平衡,正、逆反应仍在不断进行。
(3)等:
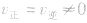 。
。(4)定:各组分的浓度及百分含量保持一定。
(5)变:当影响化学平衡的外界条件发生变化使
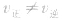 时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。化学平衡状态的判断:
1.
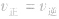 指的是同一物质的正反应速率与逆反应速率相等。
指的是同一物质的正反应速率与逆反应速率相等。 2.反应混合物中各组分的含量(质量分数、体积分数、物质的量分数)保持不变。
3.反应类型分析对于密闭容器中的反应
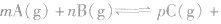 qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。
qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。

发现相似题
与“2L容积不变的密闭容器中,加入1.0molA和2.2molB,进行如下反...”考查相似的试题有:
- (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示__________ ,K值的大小与温度的关系是:温度升高,K值__________ (...
- 下列关于化学平衡的说法错误的是A.化学平衡描述的是可逆反应B.可逆反应达到化学平衡状态时,正、逆反应速率都为0C.可逆反...
- 一定条件下在2 L的密闭容器内充入2 mol SO2和一定量的O2,发生反应2SO2(g)+O2(g)2SO3(g),进行到4 min测得n(SO2)="0.4"...
- 在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法...
- 在一定条件下,向1 L密闭容器中充入3 mol X 气体和1 mol Y气体,发生反应2X(g)+2Y(g)3Z(g)+2W(g),达到化学平衡时,测出的...
- 在一定温度下可逆反应H2(g)+I2(g)⇌2HI(g)达到平衡的标志是( )A.有1molH-H键断裂,同时有1molI-I键形成B.容器内压强...
- 在容积可变的密闭容器中,2molA和8molB在一定条件下发生反应:A+3B2C,达到平衡时,B的转化率为25%,则平衡时A的体积分数接近...
- 下列是一些同学学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是A.怎样在一定时间内快...
- 在一固定容积的密闭容器中充入2 mol A 和1 mol B ,发生反应:2A(g)+ B(g)xC(g),达到平衡后,C的体积分数为W% 。若维...
- 煤化工中常需研究不同温度下平衡常数、投料比等问题。已知:CO (g) +H2O (g)H2(g) +CO2(g)平衡常数K随温度的变化如下表:回答...