本试题 “在化学学习中,常常需要利用数据进行比较.下列比较中正确的是( )A.比较碳的质量分数,CO2高于COB.在空气中,氧气的体积分数高于氮气C.组成地壳的元素含...” 主要考查您对空气的成分
原子结构
原子的定义
物质组成元素的质量分数
地壳中各种元素的含量
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 空气的成分
- 原子结构
- 原子的定义
- 物质组成元素的质量分数
- 地壳中各种元素的含量
空气的成分:
氧气,二氧化碳,氢气,氮气,稀有气体;按体积分:N2占78%,O2占21%,稀有气体占0.94%,二氧化碳占0.03%,其他气体和杂质占0.03%。
易错点:
空气中各成分的含量在一定时间和一定范围内基本恒定,但随着人类活动的延续,气体的排放,空气的成分也在不停地变化,因此不能认为空气的成分是一成不变的。
氧气,二氧化碳,氢气,氮气,稀有气体;按体积分:N2占78%,O2占21%,稀有气体占0.94%,二氧化碳占0.03%,其他气体和杂质占0.03%。
易错点:
空气中各成分的含量在一定时间和一定范围内基本恒定,但随着人类活动的延续,气体的排放,空气的成分也在不停地变化,因此不能认为空气的成分是一成不变的。
原子的构成:

原子核的构成:

原子核相对原子来说,体积很小,但质量却很大,原子的质量主要集中在原子核上,电子的质量约为质子质量的 。
。
质子的质量为:1.6726×10-27kg
中子的质量为:1.6749×10-27kg
构成原子的粒子间的关系:

对原子构成的正确理解:
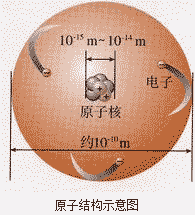
(1)原子核位于原子中心,绝大多数由质子和中构成 (有一种氢原子的原子核内只含有1个质子,无中子),体积极小,密度极大,几乎集中了原子的全部质量,核外电子质量很小,可以忽略不计。
(2)每个原子只有一个原子核,核电荷数(核内质子数)的多少,决定了原了的种类。
(3)在原子中:核电荷数二质子数二核外电子数。
(4)原子核内的质子数不一定等干中子数,如钠原子中,质子数为11,中子数为12。
(5)并不是所有的原子中都有中子,如有一种氢原子中就没有中子。
(6)在原子中,由于质子(原子核)与电子所带电荷数相等,且电性相反,因而原子中虽然存在带电的粒子,但原子在整体上不显电性。
核外电子的排布:
①电子层核外电子运动有自己的特点,在含有多个电子的原子里,有的电子通常在离核较近的区域运动,有的电子通常在离核较远的区域运动,科学家形象地将这些区域称为电子层。
②核外电子的分层排布通常用电子层来形象地表示运动着的电子离核远近的不同:离核越近,电子能量越低;离核越远,电子能量越高。电子层数、离核远近、能量高低的关系如下所示:
电子层数 1 2 3 4 5 6 7
离核远近 近→ 远
能量高低 低→ 高
③核外电子排布的规律了解一些核外电子排布的简单规律对理解原子核外电子排布的情况有很重要的作川,核外电子排布的简单规律主要有:
a.每层上的电子数最多不超过2n2(n为电子层数),如第一电子层上的电子数可能为1,也可能为2,但最多为2。
b.核外电子排布时先排第一层,排满第一层后,再排第二层,依次类推。
c.最外层上的电子数不超过8;当只有一个电子层时,最外层上的电子数不超过2。

原子的不可再分与原子的结构:
化学变化中原子不会由一种原子变成另外一种原子,即化学变化中原了的种类不变,其原因是化学变化中原子核没有发生变化。如硫燃烧生成了二氧化硫,硫和氧气中分别含有硫原子和氧原子,反应后生成的二氧化硫中仍然含硫原子和氧原子。原子不是最小粒子,只是在化学变化的范围内为“最小粒子”,它还可再分,如原子弹爆炸时的核裂变,就是原子发生了变化。原子尽管很小,但具有一定的构成,是由居于原子中心的带正电的原子核和核外带负电的电子构成的。

原子核的构成:

原子核相对原子来说,体积很小,但质量却很大,原子的质量主要集中在原子核上,电子的质量约为质子质量的
 。
。质子的质量为:1.6726×10-27kg
中子的质量为:1.6749×10-27kg
构成原子的粒子间的关系:

对原子构成的正确理解:
(1)原子核位于原子中心,绝大多数由质子和中构成 (有一种氢原子的原子核内只含有1个质子,无中子),体积极小,密度极大,几乎集中了原子的全部质量,核外电子质量很小,可以忽略不计。
(2)每个原子只有一个原子核,核电荷数(核内质子数)的多少,决定了原了的种类。
(3)在原子中:核电荷数二质子数二核外电子数。
(4)原子核内的质子数不一定等干中子数,如钠原子中,质子数为11,中子数为12。
(5)并不是所有的原子中都有中子,如有一种氢原子中就没有中子。
(6)在原子中,由于质子(原子核)与电子所带电荷数相等,且电性相反,因而原子中虽然存在带电的粒子,但原子在整体上不显电性。
核外电子的排布:
①电子层核外电子运动有自己的特点,在含有多个电子的原子里,有的电子通常在离核较近的区域运动,有的电子通常在离核较远的区域运动,科学家形象地将这些区域称为电子层。
②核外电子的分层排布通常用电子层来形象地表示运动着的电子离核远近的不同:离核越近,电子能量越低;离核越远,电子能量越高。电子层数、离核远近、能量高低的关系如下所示:
电子层数 1 2 3 4 5 6 7
离核远近 近→ 远
能量高低 低→ 高
③核外电子排布的规律了解一些核外电子排布的简单规律对理解原子核外电子排布的情况有很重要的作川,核外电子排布的简单规律主要有:
a.每层上的电子数最多不超过2n2(n为电子层数),如第一电子层上的电子数可能为1,也可能为2,但最多为2。
b.核外电子排布时先排第一层,排满第一层后,再排第二层,依次类推。
c.最外层上的电子数不超过8;当只有一个电子层时,最外层上的电子数不超过2。

原子的不可再分与原子的结构:
化学变化中原子不会由一种原子变成另外一种原子,即化学变化中原了的种类不变,其原因是化学变化中原子核没有发生变化。如硫燃烧生成了二氧化硫,硫和氧气中分别含有硫原子和氧原子,反应后生成的二氧化硫中仍然含硫原子和氧原子。原子不是最小粒子,只是在化学变化的范围内为“最小粒子”,它还可再分,如原子弹爆炸时的核裂变,就是原子发生了变化。原子尽管很小,但具有一定的构成,是由居于原子中心的带正电的原子核和核外带负电的电子构成的。
原子结构示意图:
由原子构成的物质:
绝大多数的单质是由原子构成的,如金属单质、稀有气体均是由原子直接构成的,碳、硫、磷等大多数的非金属单质也是由原子直接构成的。
原子的定义:
原子是化学变化中最小的粒子。例如,化学变化中,发生变化的是分子,原子的种类和数目都未发生变化。
对原子的概念可从以下三个方面理解:
①原子是构成物质的基本粒子之一。
②原了也可以保持物质的化学性质,如由原子直接构成的物质的化学性质就由原子保持。
③原子在化学变化中不能再分,是“化学变化中最小的粒子”,脱离化学变化这一条件,原子仍可再分。
原子的性质:
①原子的质量、体积都很小;
②原子在不停地运动;
③原子之间有一定的间隔;
④原子可以构成分子,如一个氧分子是由两个氧原子构成的;也可以直接构成物质,如稀有气体、铁、汞等都是由原子直接构成的;
⑤化学反应中原子不可再分。
原子的表示方法—元素符号:
原子可用元索符号表示:如O既可表示氧元素,也可表示1个氧原子。
分子和原子的联系与区别:
道尔顿的原子模型:
英国自然科学家约翰·道尔顿将古希腊思辨的原子论改造成定量的化学理论,提出了世界上第一个原子的理论模型。他的理论主要有以下四点:
①所有物质都是由非常微小的、不可再分的物质微粒即原子组成
②同种元素的原子的各种性质和质量都相同,不同元素的原子,主要表现为质量的不同
③原子是微小的、不可再分的实心球体
④原子是参加化学变化的最小单位,在化学反应中,原子仅仅是重新排列,而不会被创造或者消失。 虽然,经过后人证实,这是一个失败的理论模型,但道尔顿第一次将原子从哲学带入化学研究中,明确了今后化学家们努力的方向,化学真正从古老的炼金术中摆脱出来,道尔顿也因此被后人誉为“近代化学之父”。

由原子构成的物质:
绝大多数的单质是由原子构成的,如金属单质、稀有气体均是由原子直接构成的,碳、硫、磷等大多数的非金属单质也是由原子直接构成的。
原子的定义:
原子是化学变化中最小的粒子。例如,化学变化中,发生变化的是分子,原子的种类和数目都未发生变化。
对原子的概念可从以下三个方面理解:
①原子是构成物质的基本粒子之一。
②原了也可以保持物质的化学性质,如由原子直接构成的物质的化学性质就由原子保持。
③原子在化学变化中不能再分,是“化学变化中最小的粒子”,脱离化学变化这一条件,原子仍可再分。
原子的性质:
①原子的质量、体积都很小;
②原子在不停地运动;
③原子之间有一定的间隔;
④原子可以构成分子,如一个氧分子是由两个氧原子构成的;也可以直接构成物质,如稀有气体、铁、汞等都是由原子直接构成的;
⑤化学反应中原子不可再分。
原子的表示方法—元素符号:
原子可用元索符号表示:如O既可表示氧元素,也可表示1个氧原子。
分子和原子的联系与区别:
| 项目 | 分子 | 原子 | |
| 不同点 | 本质区别 | 在化学反应中可以分成原子 | 在化学反应中不能再分 |
| 构成物质情况 | 大多数物质由分子构成 | 原子也能直接构成物质,但分子是由原子构成的 | |
| 相同点 | ①质量和体积都很小 ②都在不停地运动 ③粒子间有间隔 ④都是构成物质的粒子 ⑤同种粒子性质相同,不同种粒子性质不同 | ||
| 注意事项 | ①分子是保持物质化学性质的最小粒子 ②原子是化学变化中的最小粒子 ③分子是由原子构成的 ④对于由原子直接构成的物质,原子是保持其化学性质的最小粒子 | ||
| 联系 | 分子是由原子构成的,分子,原子都是构成物质的粒子,它们的关系是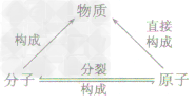 | ||
道尔顿的原子模型:
英国自然科学家约翰·道尔顿将古希腊思辨的原子论改造成定量的化学理论,提出了世界上第一个原子的理论模型。他的理论主要有以下四点:
①所有物质都是由非常微小的、不可再分的物质微粒即原子组成
②同种元素的原子的各种性质和质量都相同,不同元素的原子,主要表现为质量的不同
③原子是微小的、不可再分的实心球体
④原子是参加化学变化的最小单位,在化学反应中,原子仅仅是重新排列,而不会被创造或者消失。 虽然,经过后人证实,这是一个失败的理论模型,但道尔顿第一次将原子从哲学带入化学研究中,明确了今后化学家们努力的方向,化学真正从古老的炼金术中摆脱出来,道尔顿也因此被后人誉为“近代化学之父”。
定义:
物质中某元素的质量分数,就是该元素的质量与组成物质的各元素总质量之比。
公式:
某元素的质量分数=
如AmBn中A元素的质量分数=
若题目给出物质的化学式,又同时知道物质的实际质量,则可根据物质的质量×某元素的质量分数=该元素的质量,将其中所含元素的质量求出。同理,物质的质量=某元素质量÷该元素的质量分数。
公式的理解:
计算时应先列式计算,然后代入数据算出结果。如水中氢元素的质量分数=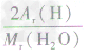 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%而不能写成
×100%=11.1%而不能写成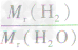 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%
×100%=11.1%
化学式中质量分数的应用:
①已知物质的质量求所含的某元素的质量
利用公式:元素的质量=物质的质量×该元素的质量分数
②已知元素的质量求物质的质量
利用公式:物质的质量=元素的质量÷该元素的质量分数
③根据元素的质量分数确定物质的化学式
利用化学式的变形比较元素质量分数的大小:
例: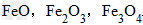 三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?
三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?
解析:三种含铁的氧化物的化学式可变形为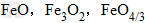 ,则三种含铁的氧化物中铁元素的质量分数分别为:
,则三种含铁的氧化物中铁元素的质量分数分别为: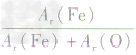 、
、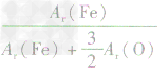 、
、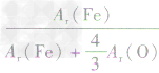 ,通过比较分母可知:
,通过比较分母可知: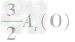 >
>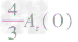 >Ar(O),故铁元素的质量分数由大到小排列的顺序为
>Ar(O),故铁元素的质量分数由大到小排列的顺序为 。
。
物质中某元素的质量分数,就是该元素的质量与组成物质的各元素总质量之比。
公式:
某元素的质量分数=

如AmBn中A元素的质量分数=

若题目给出物质的化学式,又同时知道物质的实际质量,则可根据物质的质量×某元素的质量分数=该元素的质量,将其中所含元素的质量求出。同理,物质的质量=某元素质量÷该元素的质量分数。
公式的理解:
计算时应先列式计算,然后代入数据算出结果。如水中氢元素的质量分数=
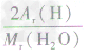 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%而不能写成
×100%=11.1%而不能写成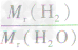 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%
×100%=11.1%化学式中质量分数的应用:
①已知物质的质量求所含的某元素的质量
利用公式:元素的质量=物质的质量×该元素的质量分数
②已知元素的质量求物质的质量
利用公式:物质的质量=元素的质量÷该元素的质量分数
③根据元素的质量分数确定物质的化学式
利用化学式的变形比较元素质量分数的大小:
例:
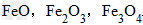 三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?
三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?解析:三种含铁的氧化物的化学式可变形为
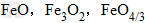 ,则三种含铁的氧化物中铁元素的质量分数分别为:
,则三种含铁的氧化物中铁元素的质量分数分别为: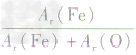 、
、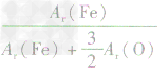 、
、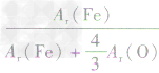 ,通过比较分母可知:
,通过比较分母可知: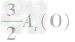 >
>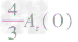 >Ar(O),故铁元素的质量分数由大到小排列的顺序为
>Ar(O),故铁元素的质量分数由大到小排列的顺序为 。
。地壳中的元素分布:
地壳是由沙、黏土、岩石等组成的,其中含量最多的是氧元素,含量排在第二位至第五位的元素依次是硅、铝、铁、钙等。地壳中含量最高的非金属元素是氧元素;地壳中含量最高的金属元素是铝元素。(关键记清地壳中含量最高的前四位元素)
海水中元素分布:
海水中的元素分布海洋约占地球表面的70%左右,海水中的元素含量分布如下表所示。其中含量最多的是氧元素。其次是氢元素,这两种元素约占总量的96.5%。
人体中元素分布:
水占人体体重的70%左右。组成人体的元素中含最最多的是氧元索,其次是碳、氢、氮元素。碳,氢、氮三种元素在地壳中的含量较少,但却是生命的必需元素。
地壳是由沙、黏土、岩石等组成的,其中含量最多的是氧元素,含量排在第二位至第五位的元素依次是硅、铝、铁、钙等。地壳中含量最高的非金属元素是氧元素;地壳中含量最高的金属元素是铝元素。(关键记清地壳中含量最高的前四位元素)
海水中元素分布:
海水中的元素分布海洋约占地球表面的70%左右,海水中的元素含量分布如下表所示。其中含量最多的是氧元素。其次是氢元素,这两种元素约占总量的96.5%。
| 元素 | O | H | Cl | Na、Mg |
| 质量分数/% | 85.5 | 10.7 | 2.0 | 1.5 |
人体中元素分布:
水占人体体重的70%左右。组成人体的元素中含最最多的是氧元索,其次是碳、氢、氮元素。碳,氢、氮三种元素在地壳中的含量较少,但却是生命的必需元素。
| 元素 | O | C | H | N | Ca | P | S、K |
| 质量分数/% | 65 | 18 | 10 | 3 | 1.5 | 1.0 | 1.5 |
发现相似题
与“在化学学习中,常常需要利用数据进行比较.下列比较中正确的...”考查相似的试题有:
- 下列物质发生的变化与空气的成分无关的是( )A.钢铁在空气中生锈B.生石灰在空气中变质C.烧碱固体在空气中潮解、变质D.碳...
- A、B两块纯铜片,插在CuSO4稀溶液中,铜片通过导线、变阻器和开关分别与直流电源的两极相连.调节变阻器滑片位置,使电流强度...
- 正误判断,填“正确”或“错误”A.物质本身没有好与坏之分,而人们对物质的应用却存在合理与不合理之分.______B.对于化学变化...
- 在SO2、CO2、NO2各一个分子中( )A.均含有一个氧分子B.都含有两个氧元素C.含氧原子个数相等D.氧元素的质量分数相等
- 今年4月,北京奥运会“祥云”火炬载着中国人民对世界人民的友谊,开始了全球传递.它采用的燃料是丙烷(分子结构模型如图),下...
- 海水中的水约占海水质量的65%-70%,则海水中含量最多的元素是______;人类须臾离不开空气是因为空气中含有供人呼吸的______;...
- 下列对原子结构的认识错误的是( )A.原子核体积很小B.原子核带正电C.原子内部有相对很大的空间D.原子是实心的球体
- 原子最外层电子数少于4的元素,一定是金属元素.______(判断对错)
- 已知由NaHS.MgSO4.NaHSO4组成的混合物中硫元素的质量分数为a%,则氧元素的质量分数为( )A.1.75 a%B.1.25 a%C.1-1...
- 下列对有关主题知识的归纳错误的是[ ]A.认识元素B.元素与人体健康C.生活常识D.环保与物质的利用