本试题 “某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列...” 主要考查您对碳酸钠
偏铝酸盐
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 碳酸钠
- 偏铝酸盐
碳酸钠(Na2CO3):
(1)俗名:纯碱或苏打;白色粉末,易溶于水,稳定;可用于制玻璃、肥皂、造纸、防治等
(2)与H+反应:CO32-+2H+==CO2↑+H2O
(3)与NaOH不反应
(4)与石灰水反应:CO32-+Ca2+==CaCO3↓
(5)与氯化钡反应:CO32-+Ba2+==BaCO3↓
(6)与CO2反应:CO32-+CO2+H2O==2HCO3-
碳酸钠的物理性质:
碳酸钠常温下为白色粉末或颗粒。溶于水和甘油,不溶于乙醇。水溶液呈强碱性,pH11.6。
碳酸钠是一种强碱盐,溶于水后发生水解反应(碳酸钠水解会产生碳酸氢钠和氢氧化钠),使溶液显碱性,有一定的腐蚀性,能与酸进行复分解反应。
稳定性 稳定性较强,但高温下也可分解,生成氧化钠和二氧化碳。长期暴露在空气中能吸收空气中的水分及二氧化碳,生成碳酸氢钠,并结成硬块。吸湿性很强,很容易结成硬块,在高温下也不分解。含有结晶水的碳酸钠有3种:Na2CO3·H2O、Na2CO3·7H2O和Na2CO3·10H2O。
碳酸钠的用途:
用于制玻璃、肥皂、造纸、纺织等工业,也用作食品工业发酵剂。
Na2CO3、NaHCO3的性质比较:
| 表示 | 名称 | 碳酸钠 | 碳酸氢钠 |
| 化学式 | Na2CO3 | NaHCO3 | |
| 俗称 | 苏打 | 小苏打 | |
| 物理性质 | 色态 | 白色粉末 | 白色晶体 |
| 溶解性 | 易溶于水 | 能溶于水 | |
| 化学性质 | 与盐酸反应 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ | NaHCO3+HCl=NaCl+H2O+CO2↑ |
| 热稳定性 | 很稳定 | 受热分解:2NaHCO3=(加热)=Na2CO3+H2O+CO2↑ | |
| 与NaOH反应 | 不反应 | NaHCO3+NaOH=Na2CO3+H2O | |
| 相互转化 | Na2CO3+H2O+CO2=2NaHCO3 | NaHCO3+NaOH=Na2CO3+H2O 2NaHCO3=(加热)=Na2CO3+H2O+CO2↑ |
Na2CO3、NaHCO3的鉴别:

Na2CO3、NaHCO3与足量盐酸反应的比较:
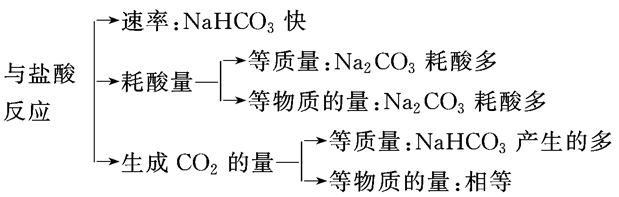
Na2CO3溶液与盐酸反应:
滴加顺序不同,现象不同,化学方程式不同。
①向盐酸里逐滴加入Na2CO3溶液(开始时酸过量) 2HCl+Na2CO3===2NaCl+CO2↑+H2O
②向Na2CO3溶液里逐滴加入盐酸(开始时酸不足) HCl+Na2CO3==NaCl+NaHCO3(无气泡) HCl+NaHCO3==NaCl+CO2↑+H2O(后来有气泡)
[特别提醒]
(1)Na2CO3和盐酸可以用互滴法鉴别。
(2)滴加顺序不同,放出CO2的量可能相同,也可能不同。
碳酸钠、碳酸氢钠与盐酸反应的基本图像的归纳总结:
(1)向Na2CO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图1所示;
(2)向NaHCO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图2所示;
(3)向NaOH、Na2CO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图3所示(设NaOH、Na2CO3的物质的量之比x∶y=1∶1,其他比例时的图像略);
(4)向Na2CO3、NaHCO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图4所示(设Na2CO3、NaHCO3的物质的量之比m∶n=1∶1,其他比例时的图像略)。
偏铝酸盐:
偏铝酸盐是指含有“AlO2-”集团的盐,是铝及其氧化物与强碱反应的产物。
例如Al(OH)3+OH-═AlO2-+2H2O。
偏铝酸盐的性质用离子方程式表示如下: ①偏铝酸盐溶液发生水解反应,溶液呈碱性。 ALO2-+2H2O==AL(OH)3+OH- ②偏铝酸盐与酸反应与强酸发生反应:适量强酸:ALO2-+H+H2O==AL(OH)3 过量强酸:ALO2-+4H+==AL3++2H2O 与弱酸(H2CO3)发生反应:即通入CO2气适量CO2:2ALO2-+CO2+3H2O==2AL(OH)3+CO32- 过量CO2:ALO2-+CO2+2H2O==AL(OH)3+HCO3- ③铝盐与偏铝酸盐溶液反应: AL3++3ALO2-+6H2O==4AL(OH)3 偏铝酸盐也可以理解为两性物质Al盐偏碱性的盐。AlO2-+H+(少量)+H2O==Al(OH)3↓
AlO2-+4H+(过量)==Al3++2H2O
偏铝酸盐的性质:
偏铝酸盐的性质用离子方程式表示如下:
①偏铝酸盐溶液发生水解反应,溶液呈碱性。AlO2-+2H2O==Al(OH)3+OH-
②偏铝酸盐与酸反应与强酸发生反应:
适量强酸:AlO2-+H++H2O==Al(OH)3
过量强酸:AlO2-+4H+==Al3++2H2O
与弱酸(H2CO3)发生反应:即通入适量CO2:2AlO2-+CO2+3H2O==2Al(OH)3+CO32-
过量CO2:AlO2-+CO2+2H2O==Al(OH)3+HCO3-
③铝盐与偏铝酸盐溶液反应:Al3++3AlO2-+6H2O==4Al(OH)3偏铝酸盐也可以理解为两性物质Al盐偏碱性的盐。
方法与技巧:
偏铝酸盐是在强碱性条件下生成的,所以它的存在环境也是强碱性环境,在离子共存题目中,经常遇到含有AlO2-的情况,遇到这样的题目,我们可以认为该溶液中含有OH-,与很多显酸性的离子不共存。例如:AlO2-与Al3+、Fe3+、NH4+、HCO3-等常见离子不共存。
“铝三角”关系:
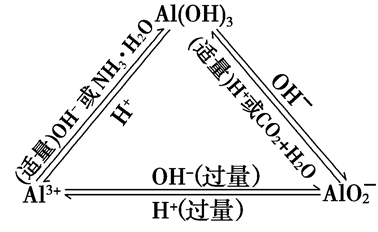
Al3++3OH-===Al(OH)3↓
Al(OH)3+OH-===AlO2-+2H2O
Al3++4OH-===AlO2-+2H2O
AlO2-+2H2O+CO2===Al(OH)3↓+HCO3-
AlO2-+H++H2O===Al(OH)3↓
AlO2-+4H+===Al3++2H2O
与“某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得...”考查相似的试题有:
- 工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下Ⅰ、碳酸钠的饱和溶液在不同温...
- 下表各组物质中,物质之间不可能实现如图所示转化的是[ ]XYZMA.Al3+ Al(OH)3AlO2-NaOHB.Fe FeCl2FeCl3Cl2C.NaOH Na2CO3NaHCO...
- 下列对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是[ ]陈述Ⅰ 陈述Ⅱ 判断 A.碳酸钠溶液可用于治疗胃病Na2CO3可...
- 下列有关Na2CO3和NaHCO3的性质比较中,正确的是[ ]A.热稳定性:Na2CO33B.碱性:Na2CO3NaHCO3D.与足量的盐酸反应产生的气体...
- 物质间的三角转化关系是化学常见关系,如图,已知A、B、C都含有同一种元素X,且A、B、C之间可以相互转化。(1)若A是常见金属的...
- 对于钠和钠的化合物的性质或用途的相 关叙述不正确的是A.用钠作还原剂可以从锆的氯化物中制备锆B.钠和钾的合金常温下为液体...
- A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化关系如图所示(部分产物已略去)。请...
- A、B、D是三种常见的短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数3个,是D元素原子最外层电子数的一半,A元素...
- 下列描述违背化学原理的是[ ]A.NaHCO3溶液与NaAlO2溶液混合产生白色沉淀,说明酸性:HCO3->Al(OH)3B.将SO2通入酸性高锰酸...
- 下图中A~J分别代表有关反应中的一种单质或化合物,其中B、C、D、I均为无色气体。(部分产物和反应条件已略去)(1)若A加热后得...