本试题 “元素原子间在形成物质时,其结合方式与其核外电子排布有密切关系,已知P原子的价电子排布为3s23p3,其与Cl可形成PCl3、PCl5两种化合物,请判断下列关于该两种...” 主要考查您对价层电子对互斥理论
σ键、π键
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 价层电子对互斥理论
- σ键、π键
价层电子对互斥理论:
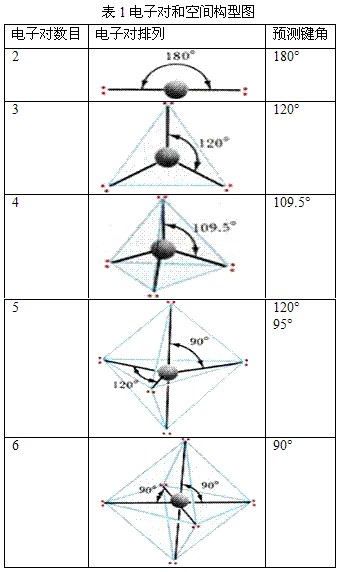
1940年美国的Sidgwick NV等人相继提出了价层电子对互斥理论(valence shell electron pair repulsion theory),简 称VSEPR法,该法适用于主族元素间形成的ABn型分子或离子。该理论认为,一个共价分子或离子中,中心原子A周围所配置的原子B(配位原子)的几何构型,主要决定于中心原子的价电子层中各电子对间的相互排斥作用。这些电子对在中心原子周围按尽可能互相远离的位置排布,以使彼此间的排斥能最小。所谓价层电子对,指的是形成σ键的电子对和孤对电子。孤对电子的存在,增加了电子对间的排斥力,影响了分子中的键角,会改变分子构型的基本类型。根据此理论,只要知道分子或离子中的中心原子上的价层电子对数,就能比较容易而准确地判断ABn型共价分子或离子的空间构型。
确定中心原子中价层电子对数:
中心原子的价层电子数和配体所提供的共用电子数的总和除以2,即为中心原子的价层电子对数。
规定:
①作为配体,卤素原子和H原子提供1个电子,氧族元素的原子不提供电子;
②作为中心原子,卤素原子按提供7个电子计算,氧族元素的原子按提供6个电子计算;
③对于复杂离子,在计算价层电子对数时,还应加上负离子的电荷数或减去正离子的电荷数;
④计算电子对数时,若剩余1个电子,亦当作1对电子处理。
⑤双键、叁键等多重键作为1对电子看待
判断分子的空间构型:
根据中心原子的价层电子对数,从表1中找出相应的价层电子对构型后,再根据价层电子对中的孤对电子数,确定电子对的排布方式和分子的空间构型。
1940年美国的Sidgwick NV等人相继提出了价层电子对互斥理论(valence shell electron pair repulsion theory),简 称VSEPR法,该法适用于主族元素间形成的ABn型分子或离子。该理论认为,一个共价分子或离子中,中心原子A周围所配置的原子B(配位原子)的几何构型,主要决定于中心原子的价电子层中各电子对间的相互排斥作用。这些电子对在中心原子周围按尽可能互相远离的位置排布,以使彼此间的排斥能最小。所谓价层电子对,指的是形成σ键的电子对和孤对电子。孤对电子的存在,增加了电子对间的排斥力,影响了分子中的键角,会改变分子构型的基本类型。根据此理论,只要知道分子或离子中的中心原子上的价层电子对数,就能比较容易而准确地判断ABn型共价分子或离子的空间构型。
确定中心原子中价层电子对数:
中心原子的价层电子数和配体所提供的共用电子数的总和除以2,即为中心原子的价层电子对数。
规定:
①作为配体,卤素原子和H原子提供1个电子,氧族元素的原子不提供电子;
②作为中心原子,卤素原子按提供7个电子计算,氧族元素的原子按提供6个电子计算;
③对于复杂离子,在计算价层电子对数时,还应加上负离子的电荷数或减去正离子的电荷数;
④计算电子对数时,若剩余1个电子,亦当作1对电子处理。
⑤双键、叁键等多重键作为1对电子看待
判断分子的空间构型:
根据中心原子的价层电子对数,从表1中找出相应的价层电子对构型后,再根据价层电子对中的孤对电子数,确定电子对的排布方式和分子的空间构型。

σ键:
成键原子的电子云以“头碰头”方式重叠形成的共价键,其特征是轴对称,即以形成化学键的两原子核的连线为轴作旋转,共价键的电子云图形不变。
π键:
成键原子的电子云以“肩并肩”方式形成的共价键,其特征是镜像对称,即:电子云由两块组成,若以包含原子核的平面为镜面,两块电子云互为镜像。
成键原子的电子云以“头碰头”方式重叠形成的共价键,其特征是轴对称,即以形成化学键的两原子核的连线为轴作旋转,共价键的电子云图形不变。
π键:
成键原子的电子云以“肩并肩”方式形成的共价键,其特征是镜像对称,即:电子云由两块组成,若以包含原子核的平面为镜面,两块电子云互为镜像。
共价键的分类:
(1)按成键原子是否相同或共用电子对是否偏移分 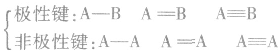
(2)按成键方式分

(3)按共用电子对数分
发现相似题
与“元素原子间在形成物质时,其结合方式与其核外电子排布有密切...”考查相似的试题有:
- 试用价层电子对互斥理论判断ClF3可能有几种结构,哪一种结构最稳定?_________________________________
- 碳族元素包括C、Si、 Ge、Sn、Pb。(1)碳纳米管由单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过_________...
- 黄血盐(亚铁氰化钾,K4[Fe(CN)6] )易溶于水,广泛用做食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10 mg·kg-1。黄血...
- 下列说法中不正确的是[ ]A.σ键比π键重叠程度大,形成的共价键强B.两个原子之间形成共价键时,最多有一个σ键C.气体单质中,...
- Ⅰ铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。(1...
- 用符号“>”“
- 下列说法中不正确的是[ ]A.σ键的电子云分布对键轴方向呈圆柱形对称B.π键的电子云分布是对通过键轴的平面呈镜面对称C.σ键比...
- 做实验时不小心使皮肤上粘了一些高锰酸钾,形成的黑斑很久才能消除,如果用乙二酸的稀溶液洗涤,黑斑可以迅速褪去,其离子方...
- 由两种短周期元素组成的A、B、C、D化合物分子,均含有18个电子,它们分子中所含原子的数目依次为2、3、4、6。A和C分子中的原...
- 下列对σ键的认识不正确的是[ ]A.σ键不属于共价键,是另一种化学键B.s-sσ键与s-pσ键的对称性不同C.分子中含有共价键,则至...