本试题 “下表列出了1-18号元素的原子序数和元素符号:请回答下列问题:(1)1-18号元素中属于稀有气体的有氦、_________(填元素名称)、氩。(2)1-18号元素中最外层有2个...” 主要考查您对稀有气体的性质和用途
原子结构
原子结构示意图
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 稀有气体的性质和用途
- 原子结构
- 原子结构示意图
定义及化学式:
1.稀有气体是氦、氖、氩、氪、氙、氡等气体的总称,过去人们认为这些气体不跟其他物质发生反应,故又称它们为“惰性气体”。
2.名称及化学式:氦(He)、氖(Ne)、氩(Ar)、氪(Kr)、氙(Xe)、氡(Rn)。
稀有气体的性质和用途:
1. 物理性质:稀有气体都是没有颜色,没有气味的其他,难溶于水。
2. 化学性质:极不活泼,一般不与其他物质发生反应。
3. 用途:
①做保护气,如焊接金属的时候用稀有气体来隔绝空气;灯泡内充入稀有气体使灯泡耐用。
②做电光源,稀有气体在通电时能发出不能颜色的光。
③氦气用于制造低温环境。
④氙气可用于医疗麻醉。
⑤用于激光技术等。
稀有气体与电光源:
氖和氩可用在霓虹灯里。在细长的玻璃管中充入稀薄的气体,电极装在玻璃管的两端,放电时产生色光。灯光的颜色跟灯管内填充气体种类和气压有关,跟玻璃管的颜色也有关。
1.稀有气体是氦、氖、氩、氪、氙、氡等气体的总称,过去人们认为这些气体不跟其他物质发生反应,故又称它们为“惰性气体”。
2.名称及化学式:氦(He)、氖(Ne)、氩(Ar)、氪(Kr)、氙(Xe)、氡(Rn)。
稀有气体的性质和用途:
1. 物理性质:稀有气体都是没有颜色,没有气味的其他,难溶于水。
2. 化学性质:极不活泼,一般不与其他物质发生反应。
3. 用途:
①做保护气,如焊接金属的时候用稀有气体来隔绝空气;灯泡内充入稀有气体使灯泡耐用。
②做电光源,稀有气体在通电时能发出不能颜色的光。
③氦气用于制造低温环境。
④氙气可用于医疗麻醉。
⑤用于激光技术等。
稀有气体与电光源:
氖和氩可用在霓虹灯里。在细长的玻璃管中充入稀薄的气体,电极装在玻璃管的两端,放电时产生色光。灯光的颜色跟灯管内填充气体种类和气压有关,跟玻璃管的颜色也有关。
| 灯色 | 气体 | 玻璃管的颜色 |
| 大红 | 氖 | 无 |
| 深红 | 氖 | 淡红 |
| 金黄 | 氦 | 淡红 |
| 蓝 | 体积分数:氩80%,氖20% | 淡蓝 |
| 绿 | 体积分数:氩80%,氖20% | 淡黄 |
| 紫 | 体积分数:氩50%,氖50% | 无 |
原子的构成:

原子核的构成:

原子核相对原子来说,体积很小,但质量却很大,原子的质量主要集中在原子核上,电子的质量约为质子质量的 。
。
质子的质量为:1.6726×10-27kg
中子的质量为:1.6749×10-27kg
构成原子的粒子间的关系:

对原子构成的正确理解:
(1)原子核位于原子中心,绝大多数由质子和中构成 (有一种氢原子的原子核内只含有1个质子,无中子),体积极小,密度极大,几乎集中了原子的全部质量,核外电子质量很小,可以忽略不计。
(2)每个原子只有一个原子核,核电荷数(核内质子数)的多少,决定了原了的种类。
(3)在原子中:核电荷数二质子数二核外电子数。
(4)原子核内的质子数不一定等干中子数,如钠原子中,质子数为11,中子数为12。
(5)并不是所有的原子中都有中子,如有一种氢原子中就没有中子。
(6)在原子中,由于质子(原子核)与电子所带电荷数相等,且电性相反,因而原子中虽然存在带电的粒子,但原子在整体上不显电性。
核外电子的排布:
①电子层核外电子运动有自己的特点,在含有多个电子的原子里,有的电子通常在离核较近的区域运动,有的电子通常在离核较远的区域运动,科学家形象地将这些区域称为电子层。
②核外电子的分层排布通常用电子层来形象地表示运动着的电子离核远近的不同:离核越近,电子能量越低;离核越远,电子能量越高。电子层数、离核远近、能量高低的关系如下所示:
电子层数 1 2 3 4 5 6 7
离核远近 近→ 远
能量高低 低→ 高
③核外电子排布的规律了解一些核外电子排布的简单规律对理解原子核外电子排布的情况有很重要的作川,核外电子排布的简单规律主要有:
a.每层上的电子数最多不超过2n2(n为电子层数),如第一电子层上的电子数可能为1,也可能为2,但最多为2。
b.核外电子排布时先排第一层,排满第一层后,再排第二层,依次类推。
c.最外层上的电子数不超过8;当只有一个电子层时,最外层上的电子数不超过2。

原子的不可再分与原子的结构:
化学变化中原子不会由一种原子变成另外一种原子,即化学变化中原了的种类不变,其原因是化学变化中原子核没有发生变化。如硫燃烧生成了二氧化硫,硫和氧气中分别含有硫原子和氧原子,反应后生成的二氧化硫中仍然含硫原子和氧原子。原子不是最小粒子,只是在化学变化的范围内为“最小粒子”,它还可再分,如原子弹爆炸时的核裂变,就是原子发生了变化。原子尽管很小,但具有一定的构成,是由居于原子中心的带正电的原子核和核外带负电的电子构成的。

原子核的构成:

原子核相对原子来说,体积很小,但质量却很大,原子的质量主要集中在原子核上,电子的质量约为质子质量的
 。
。质子的质量为:1.6726×10-27kg
中子的质量为:1.6749×10-27kg
构成原子的粒子间的关系:

对原子构成的正确理解:
(1)原子核位于原子中心,绝大多数由质子和中构成 (有一种氢原子的原子核内只含有1个质子,无中子),体积极小,密度极大,几乎集中了原子的全部质量,核外电子质量很小,可以忽略不计。
(2)每个原子只有一个原子核,核电荷数(核内质子数)的多少,决定了原了的种类。
(3)在原子中:核电荷数二质子数二核外电子数。
(4)原子核内的质子数不一定等干中子数,如钠原子中,质子数为11,中子数为12。
(5)并不是所有的原子中都有中子,如有一种氢原子中就没有中子。
(6)在原子中,由于质子(原子核)与电子所带电荷数相等,且电性相反,因而原子中虽然存在带电的粒子,但原子在整体上不显电性。
核外电子的排布:
①电子层核外电子运动有自己的特点,在含有多个电子的原子里,有的电子通常在离核较近的区域运动,有的电子通常在离核较远的区域运动,科学家形象地将这些区域称为电子层。
②核外电子的分层排布通常用电子层来形象地表示运动着的电子离核远近的不同:离核越近,电子能量越低;离核越远,电子能量越高。电子层数、离核远近、能量高低的关系如下所示:
电子层数 1 2 3 4 5 6 7
离核远近 近→ 远
能量高低 低→ 高
③核外电子排布的规律了解一些核外电子排布的简单规律对理解原子核外电子排布的情况有很重要的作川,核外电子排布的简单规律主要有:
a.每层上的电子数最多不超过2n2(n为电子层数),如第一电子层上的电子数可能为1,也可能为2,但最多为2。
b.核外电子排布时先排第一层,排满第一层后,再排第二层,依次类推。
c.最外层上的电子数不超过8;当只有一个电子层时,最外层上的电子数不超过2。

原子的不可再分与原子的结构:
化学变化中原子不会由一种原子变成另外一种原子,即化学变化中原了的种类不变,其原因是化学变化中原子核没有发生变化。如硫燃烧生成了二氧化硫,硫和氧气中分别含有硫原子和氧原子,反应后生成的二氧化硫中仍然含硫原子和氧原子。原子不是最小粒子,只是在化学变化的范围内为“最小粒子”,它还可再分,如原子弹爆炸时的核裂变,就是原子发生了变化。原子尽管很小,但具有一定的构成,是由居于原子中心的带正电的原子核和核外带负电的电子构成的。
概念:
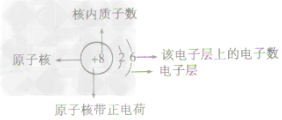
原子结构示意图(如图)是表示原子核电荷数和电子层排布的图示形式。小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数。
原子结构示意图及各部分的含义:
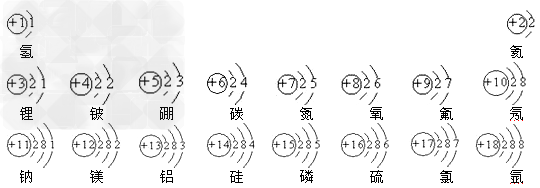
前20号元素的原子结构示意图:
原子结构示意图(如图)是表示原子核电荷数和电子层排布的图示形式。小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数。
原子结构示意图及各部分的含义:

前20号元素的原子结构示意图:

发现相似题
与“下表列出了1-18号元素的原子序数和元素符号:请回答下列问题...”考查相似的试题有:
- 科学家1996年在宇宙中发现一种由氢元素组成的新物质,化学式为H3,在一个 H3分子中有______个氢原子,H3的相对分子质量为____...
- 具有相同质子数的粒子一定是( )A.同种元素B.同种离子C.同种分子D.不能确定
- 我国研制成功一种相对原子质量为18,质子数为8的氧原子构成的双原子分子气体,下列说法正确的是 ( )A.这种原子的核外不一...
- 下列四种微粒中,具有相似的化学性质的是( )A.②③B.①③C.②④D.①④
- 钾的相对原子质量较氩的相对原子质量小1,而核电荷数大1,则可推断[ ]A.钾的中子数比氩的中子数少1个B.钾的中子数比氩的中...
- 在原子中,核外电子总数一定等于( )A.中子数B.相对原子质量C.核电荷数D.最外层电子数
- 已知氮、硅原子结构示意图如图. 氮化硅是一种新型陶瓷材料的主要成分,能承受高温,可用于制造业、航天业等.试写出氮化硅的...
- 已知碘元素(元素符号为I)的原子结构示意图为请回答下列问题.(1)x的值为______;(2)一般情况下,元素原子的最外层电子...
- 课本中的图表、数据等可以提供很多信息.下面有关的说法不正确的是( )A.根据相对分子质量可比较相同状况下气体的密度大小B...
- 氯原子结构示意图为,下列叙述错误的是[ ]A.氯原子核内有17个质子B.氯原子核外有三个电子层C.氯原子核内有17个中子D.氯原...