本试题 “可用氢氧化钠固体干燥的气体是( )A.SO2B.CO2C.H2D.HCl” 主要考查您对离子的共存
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 离子的共存
概念:
所谓离子共存,实质上就是看离子间是否发生反应的问题。若在溶液中发生反应,就不能共存。看能否发生反应,不仅是因为有沉淀、气体、水、难电离的物质产生,还涉及到溶液酸碱性、有色、无色,能否进行氧化还原反应等。
判断离子是否共存的方法:
复分解反应的实质就是两种化合物相互交换成分,生成两种新的化合物,所以同一溶液中的离子之间如符合下列条件之一就会发生反应,即离子不能在溶液中大量共存。
(1)生成沉淀:如Ag+和Cl-,Ba2+和SO42-,Ca2+和 CO32-,Cu2+和OH-等不能大量共存。
(2)生成气体:如H+和CO32-,HCO3-,NH4+和OH-等不能大量共存。
(3)生成水:如H+和OH-不能大量共存。
(4)可能会有附加条件,如溶液无色透明、pH=l (酸性溶液)、pH=14(碱性溶液)等。判断离子能否共存时,应先看清试题的前提条件再分析离子间的相互反应情况。
判断离子是否共存的几种情况:
①由于发生复分解反应,离子不能大量共存。
A.有气体产生。如CO32- 、SO32- 、S2- 、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
B.有沉淀生成。如Ba2+ 、Ca2+ 、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;
Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;
Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
C.一些酸根离子如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;
NH4+与OH-不能大量共存。
②由于发生氧化还原反应,离子不能大量共存。
A.具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
B.在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。
如MnO4-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;
SO32-和S2-在碱性条件下可以共存,
但在酸性条件下则由于发生2S2- +SO32- +6H+=3S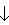 +3H2O反应不能共在。
+3H2O反应不能共在。
③溶液中能发生络合反应的离子不能大量共存。
如Fe2+ 、Fe3+与SCN-不能大量共存。
主要题目要求的限定:
①酸性溶液(H+)、碱性溶液(OH-)等不能共存的离子。
②溶液的颜色:有色离子
MnO4-(紫色)、Fe3+(棕黄)、Fe2+(浅绿)、Cu2+(蓝)等
所谓离子共存,实质上就是看离子间是否发生反应的问题。若在溶液中发生反应,就不能共存。看能否发生反应,不仅是因为有沉淀、气体、水、难电离的物质产生,还涉及到溶液酸碱性、有色、无色,能否进行氧化还原反应等。
判断离子是否共存的方法:
复分解反应的实质就是两种化合物相互交换成分,生成两种新的化合物,所以同一溶液中的离子之间如符合下列条件之一就会发生反应,即离子不能在溶液中大量共存。
(1)生成沉淀:如Ag+和Cl-,Ba2+和SO42-,Ca2+和 CO32-,Cu2+和OH-等不能大量共存。
(2)生成气体:如H+和CO32-,HCO3-,NH4+和OH-等不能大量共存。
(3)生成水:如H+和OH-不能大量共存。
(4)可能会有附加条件,如溶液无色透明、pH=l (酸性溶液)、pH=14(碱性溶液)等。判断离子能否共存时,应先看清试题的前提条件再分析离子间的相互反应情况。
判断离子是否共存的几种情况:
①由于发生复分解反应,离子不能大量共存。
A.有气体产生。如CO32- 、SO32- 、S2- 、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
B.有沉淀生成。如Ba2+ 、Ca2+ 、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;
Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;
Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
C.一些酸根离子如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;
NH4+与OH-不能大量共存。
②由于发生氧化还原反应,离子不能大量共存。
A.具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
B.在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。
如MnO4-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;
SO32-和S2-在碱性条件下可以共存,
但在酸性条件下则由于发生2S2- +SO32- +6H+=3S
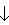 +3H2O反应不能共在。
+3H2O反应不能共在。③溶液中能发生络合反应的离子不能大量共存。
如Fe2+ 、Fe3+与SCN-不能大量共存。
主要题目要求的限定:
①酸性溶液(H+)、碱性溶液(OH-)等不能共存的离子。
②溶液的颜色:有色离子
MnO4-(紫色)、Fe3+(棕黄)、Fe2+(浅绿)、Cu2+(蓝)等
发现相似题
与“可用氢氧化钠固体干燥的气体是( )A.SO2B.CO2C.H2D.HCl”考查相似的试题有:
- 下列各组物质在pH=14的某无色溶液中,能大量共存的是[ ]A.FeCl3 NaCl KNO3B.NaCl NaOH NaNO3C.CaCl2 NaNO3 Na2CO3 D.KNO3...
- 下列离子在溶液中能大量共存的是[ ]A.H+、NO3-、CO32-B.K+、Na+、SO42-C.NH4+、OH-、SO42-D.Ag+、NO3-、Cl-
- 下列各组离子在酸性溶液中能大量共存的是[ ]A.Ag+、Na+、Cl﹣、B.Na+、K+、Cl﹣、C.K+、Na+、、Cl﹣D.Ba+、Mg2+、、
- 将下列各组物质混合后溶于水,得到无色溶液的是( )A.KNO3、ZnCl2、Na2SO4B.NaOH、KNO3、CaCO3C.CuSO4、NH4Cl、ZnCl2D.C...
- 下列各组离子在溶液中一定能大量共存的是( )A.H+、C1-、OH-B.H+、SO42-、HCO3-C.Ba2+、H+、SO42-D.Cu2+、C1-、N03-
- 下列离子能在pH=2的无色溶液中大量共存的是( )A.K+、SO42-、NO3-、Cu2+B.Cl-、K+、Na+、CO32-C.SO42-、Fe3+、Na+、OH-D...
- 下图中A、B、C、D、E、F均为化学中常见物质,其中 B在常温下为最常见液体, C为气体,E为大理石的主要成份。物质间的转化关系...
- 甲、乙两车间排放出的污水中分别含有大量且不同的4种离子,这些离子是Ag+、Ba2+、Fe3+、Na+、Cl-、NO3-、OH-、SO42-.经检测...
- (1)“奥运在我心中”。整理归纳物质性质之间的相互联系是学习化学的一种有效方法。请你从学习过的单质、氧化物、酸、碱、盐中...
- 在pH=1的下列各组溶液中能大量共存且为无色透明溶液的一组是[ ]A.FeCl2、AgNO3B.CuSO4、KNO3C.K2CO3、Ca(OH)2D.ZnSO4、KCl