本试题 “(1)在农村,每年冬季因燃烧煤取暖而造成煤气中毒的事故屡见不鲜.某中学研究性学习小组,决定对家庭使用煤炉取暖产生的尾气的成分进行探究.他们根据碳的化...” 主要考查您对二氧化碳的性质
一氧化碳的性质和用途
酸碱指示剂
中和反应及在实际中的应用
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 二氧化碳的性质
- 一氧化碳的性质和用途
- 酸碱指示剂
- 中和反应及在实际中的应用
二氧化碳是空气中常见的化合物,其分子式为CO?,由两个氧原子与一个碳原子通过共价键连接而成,常温下是一种无色无味气体,密度比空气略大,能溶于水,与水反应生成碳酸。固态二氧化碳俗称干冰。二氧化碳被认为是造成温室效应的主要来源。
物理性质:
常温下,二氧化碳是一种无色无味的气体,密度比空气大,能溶于水。
固态的二氧化碳叫做干冰。
化学性质:
(1)一般情况下,二氧化碳不能燃烧,也不支持燃烧,不供给呼吸,因此当我们进入
干枯的深井,深洞或久未开启的菜窖时,应先做一个灯火实验,以防止二氧化碳浓度
过高而造成危险
(2)二氧化碳和水反应生成碳酸,使紫色石蕊试液变红:CO2 + H2O===H2CO3,
碳酸不稳定,很容易分解成水和二氧化碳,所以红色石蕊试液又变回紫色:
H2CO3===H2O + CO2↑
(3)二氧化碳和石灰水反应:Ca(OH)2 + CO2====CaCO3↓+ H2O
(4)二氧化碳可促进植物的光合作用:6CO2+6H2O
 C6H12O6+6O2
C6H12O6+6O2 一氧化碳和二氧化碳性质的比较:
|
|
|
一氧化碳 |
二氧化碳 |
|
物理性质 |
状态 |
无色,无味气体 |
无色,无味气体 |
|
密度 |
1.250g/l(略小于空气) |
1.977g/l(大于空气) | |
|
溶解性 |
1体积水中约溶解0.02体积 |
1体积中约溶解1体积 | |
|
化学性质 |
可燃性 |
有可燃性 |
一般情况下,既不能燃烧,也不能支持燃烧 |
|
还原性 |
有还原性: |
没有还原性 | |
|
跟水反应 |
不能 |
能:CO2+H2O==H2CO3 | |
|
跟澄清石灰水反应 |
不能 |
CO2+Ca(OH)2==CaCO3↓+H2O | |
|
毒性 |
有毒 |
无毒 | |
|
主要用途 |
作气体燃料,用于高炉炼铁 |
灭火,人工降雨,干冰制冷剂等,作化工原料和温室肥料 | |
|
相互转化 |
C+O2 CO2 CO2C+CO2  2CO 2CO | ||
干冰:
一定条件下,二氧化碳气体会变成固体,固体二氧化碳叫“干冰”。干冰升华时,吸收大量的热,因此可作制冷剂。如果用飞机向云层中撤干冰,由于干冰升华吸热,空气中的水蒸气迅速冷凝变成水滴,就可以形成降雨。
二氧化碳不一定能灭火:
二氧化碳一般不支持燃烧,但在一定条件下,某些物质也可以在二氧化碳中燃烧,如将点燃的镁条伸入盛有二氧化碳的集气瓶中,镁条能继续燃烧,反应的化学方程式为:2Mg+CO2
 2MgO+C,所以活泼金属着火不能用二氧化碳来灭火
2MgO+C,所以活泼金属着火不能用二氧化碳来灭火 二氧化碳与一氧化碳的鉴别方法:
(1)澄清石灰水:将气体分别通入澄清石灰水中,能使澄清石灰水变浑浊的是二氧化碳,无明显现象的是一氧化碳。
(2)燃着的木条:将气体分别在空气中点燃,能燃烧的是一氧化碳,不能燃烧的是二氧化碳。
(3)紫色石蕊试液:将气体分别通入紫色石蕊试液中,能使石蕊试液变红的是二氧化碳,无明显现象的是一氧化碳。
(4)还原金属氧化物:将气体分别通过灼热的氧化铜,出现黑色粉末变红这一现象的是一氧化碳,没有明显现象的是二氧化碳。
二氧化碳与一氧化碳的除杂方法:
1.CO(CO2)(括号内的物质为杂质):通常将气体通人过量的碱溶液(一般用氢氧化钠溶液而不用澄清石灰水)中,二氧化碳与碱溶液反应,从而达到除杂的目的。
2.CO2(CO)(括号内的物质为杂质):通常将气体通过灼热的氧化铜,一氧化碳与氧化铜反应生成铜和二氧化碳,从而达到除杂的目的。不能用点燃的方法,因为CO2不支持燃烧,也不能燃烧。
二氧化碳与石灰石的应用:
二氧化碳与石灰水反应出现白色沉淀,反应的方程式为:CO2+Ca(OH)2==CaCO3↓+H2O。
该反应及现象有以下儿方面的应用:
(1)检验二氧化碳气体;
(2)鉴别NaOH溶液和澄清石灰水:将CO2气体通入待测溶液中,生成白色沉淀的溶液为澄清石灰水,无明显现象的为NaOH溶液;
(3)除去某些气体中的杂质:如除去CO中的CO2 气体,可将混合气体通过澄清石灰水;
(4)解释澄清石灰水为什么要密封保存:敞口放置的澄清石灰水会吸收空气中的CO2而使澄清石灰水表面生成一层白膜或变浑浊,其成分是CaCO3;
(5)用石灰砂浆砌砖抹墙不久后变白变硬:石灰砂浆的主要成分是Ca(OH)2,吸收空气中的CO2发生反应Ca(OH)2声称白色固体CaCO3固体。
(6)保存鸡蛋:将鸡蛋浸泡在澄清石灰水中,取出来后CO2与石灰水反应封闭鸡蛋壳上的小孔,可以延长鸡蛋的保存时间。
二氧化碳肥料:
二氧化碳是光合作用的原料之一,因而现在在温室大棚内种植蔬菜水果时,经常人为提高温室内CO2 浓度,以增加农作物产员,增大CO2浓度的方法通常有以下几种:
(1)在温室内放置干冰,干冰升华增大CO2浓度。
(2)在温室内放置通过化学反应产生CO2气体的物质,如在塑料大棚顶部的容器内放置石灰石和稀盐酸。
灯火实验:
(1)二氧化碳本身无毒,但它不供给呼吸,当空气中二氧化碳含量超过常量时,也会对人体健康产生不良影响。
| 空气中二氧化碳的体积分数/% | 对人体健康的影响 |
| 1 | 感到气闷,头昏,心悸 |
| 4—5 | 气喘,头痛,眩晕 |
| 10 | 神志不清,呼吸停止,死亡 |
一氧化碳(CO)纯品为无色、无臭、无刺激性的气体。分子量28.01,密度1.250g/l,冰点为-207℃,沸点-190℃。在水中的溶解度甚低。空气混合爆炸极限为12.5%~74%。一氧化碳进入人体之后会和血液中的血红蛋白结合,进而使血红蛋白不能与氧气结合,从而引起机体组织出现缺氧,导致人体窒息死亡。因此一氧化碳具有毒性。一氧化碳是无色、无臭、无味的气体,故易于忽略而致中毒。常见于家庭居室通风差的情况下,煤炉产生的煤气或液化气管道漏气或工业生产煤气以及矿井中的一氧化碳吸入而致中毒。
物理性质:
通常状况下,是一种没有颜色,气味的气体,比空气略轻难溶于水。
化学性质:
(1)可燃性:2CO + O2
 2CO2
2CO2 (2)还原性:
一氧化碳还原氧化铜:CO+ CuO
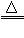 Cu + CO2
Cu + CO2 一氧化碳还原氧化铁:3CO+ Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 一氧化碳还原四氧化三铁:4CO+ Fe3O4
 3Fe + 4CO2
3Fe + 4CO2 (3)毒性:
CO极易和血液中的血红蛋白结合,从而使血红蛋白不能很好地与氧气结合,造成生物体内缺氧,严重时危及生命。CO有剧毒,人在CO的体积分数达到 0.02%的空气中持续停留2—3h即出现中毒症状,因此我们使用煤、燃气热水器时要装烟囱,注意室内通风。
用途:
用作燃料,冶炼金属。
一氧化碳和氢气的比较
| 颜色状态 | 无色,无味气体 | 无色,无味气体 |
| 密度 | 1.250g/l(略小于空气) | 0.089g/l(最轻的气体) |
| 可燃性 | 有可燃性 2CO+O2  2CO2 2CO2 |
有可燃性 2H2+O2  2H2O 2H2O |
| 还原性 | 有还原性 CO+CuO 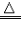 Cu+CO2 Cu+CO2 |
有还原性 H2+CuO  Cu+H2O Cu+H2O |
| 毒性 | 剧毒 | 无毒 |
| 鉴别方法 | 根据燃烧产物的不同鉴别 | |
H2、CO、C的比较
| H2 | C | CO | ||
| 可燃性 | 化学方程式 | 2H2+O2 2H2O 2H2O |
C+O2 CO2; CO2;2C+O2  2CO 2CO |
2CO+O2 2CO2 2CO2 |
| 反应现象 | 淡蓝色火焰,放热,生成 无色液体 |
发光,放热 | 蓝色火焰,放热, 生成的无色气体 能使澄清石灰水 变浑浊 | |
| 还原性 | 方程式 | 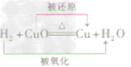 |
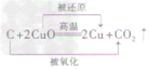 |
 |
| 反应现象 | 黑色固体变红,生成无色液体,管口有水珠 | 黑色固体变红,生成的无色气体能使澄清石灰水变洪浑浊 | 黑色固体变红,生成的无色气体能使澄清石灰水变浑浊 | |
| 装置图 |  |
 |
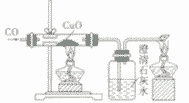 | |
| 装置要点 | 试管口略向下倾斜,导管贴试管上臂至药品上方,试管口没有橡皮塞 | 试管口略向下倾斜,导管刚过橡皮塞 | 多余的CO要进行尾气处理(如点燃) | |
| 主要步骤 | 通H2→加热→停止加热→停止通H2 | 反应结束后,先将导管从液体中取出,再停止加热 | 通CO→加热→停止加热→停止通CO | |
| 优点 | 反应条件低,生成物是水,不污染环境 | 原料便宜,操作简便 | 反应条件低 | |
| 缺点 | 不安全,操作复杂 | 反应条件高,生成物不易提纯 | 不安全,操作复杂,有毒 | |
| 用途 | 作工业原料,作高能燃料,冶炼金属 | 作燃料,冶炼金属, | 作燃料,冶炼金属, | |
(1)三种物质燃烧的现象有所不同,但不能根据火焰去鉴别CO和H2
(2)在还原CuO的实验中,必须对多余的CO进行处理
跟酸或碱的溶液起作用而显示不同颜色的物质,叫酸碱指示剂,通常也简称指示剂。
紫色石蕊试液和无色酚酞试液的显色:
紫色石蕊试液和无色酚酞试液是两种常用的酸碱指示剂,它们与酸性、碱性溶液作用时显示的颜色见下表:
| 酸性溶液 | 碱性溶液 | 中性溶液 | |
| 石蕊试液 | 红 | 蓝 | 紫 |
| 酚酞试液 | 无 | 红 | 无 |
易错点:
①变色的是指示剂,而不是酸或碱的溶液。如盐酸使紫色石蕊试液变红,不能说成紫色石蕊试液使盐酸变红,但可以说紫色石蕊试液遇盐酸变红。
②酸或碱的溶液能使紫色石蕊试液或酚酞试液变色,但能使紫色石蕊试液或酚酞试液变色的不一定是酸或碱的溶液,还可能是酸性盐溶掖或碱性盐溶液。如碳酸钠溶液能使紫色石蕊试液变蓝,但碳酸钠不是碱,而是盐。
酸碱指示剂的代用品:
在自然界里,有许多植物色素在不同的酸碱性溶液中.都会发生特定的颜色变化。这些植物色素可以用作石蕊和酚酞等指示剂的代用品。一些植物的色素及其在酸碱性溶液中的颜色变化如下:
| 代用指示剂的颜色 | |||
| 在酸性溶液中 | 在中性溶液中 | 在碱性溶液中 | |
| 牵牛花 | 红色 | 紫色 | 蓝色 |
| 苏木 | 黄色 | 红棕色 | 玫瑰红色 |
| 紫萝卜皮 | 红色 | 紫色 | 黄绿色 |
| 月季花 | 浅红色 | 红色 | 黄色 |
| 美人蕉 | 淡红色 | 红色 | 绿色 |
(1)定义:酸跟碱作用生成盐和水的反应,叫做中和反应。
(2)实质:酸中的氢离子与碱中的氢氧根离子作用生成水的过程。
概念理解:
①中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应。如Fe2O3+6HCl==2FeCl3+3H2O不是中和反应
②中和反应一定是复分解反应,但复分解反应不一定是中和反应。二者的关系是复分解反应包含了中和反应。
探究中和反应是否发生的方法:
酸与碱作用生成盐和水的反应叫中和反应,中和反应一般情况下没有明显的外观现象【H2SO4+ Ba(OH)2==BaSO4↓+2H2O除外】。
探究酸碱发生中和反应的方法有以下几种(以HCl和NaOH反应为例):
1. 指示剂法。先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
2. pH试纸法。先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时多次测定混合溶液的pH。如果测得pH逐渐变小且小于7,则证明 NaOH溶液与稀盐酸发生了化学反应。
3. 热量变化法。化学反应通常伴随着能量的变化.所以可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
中和反应的应用:
①改变土壤的酸碱性根据土壤情况,可以利用中和反应,在土壤中加人适量酸性或碱性物质,调节土壤的酸碱性,以利于植物生长。如:近年来由于空气污染造成的酸雨,导致一些地方的土壤显酸性,不利于农作物生长,人们通常向土壤中撒适量熟石灰中和其酸性。
②处理工厂的废水工厂里排出的废水有一些显酸性或碱性,直接排放会对水体和环境造成污染。通常在排出的废水中加入适量的碱性或酸性物质中和。如:废水中含有硫酸可向其中加人适从熟石灰,反应的化学方程式为:H2SO4+Ca(OH)2==CaSO4+2H2O。
③用于医药人体胃酸(主要成分是盐酸)过多,会造成消化不良,甚至会产生胃病,通常服用呈碱性的物质来消除症状,如氢氧化铝,反应的化学方程式为:3HCl+Al(OH)3== AlCl3+3H2O。被蚊虫叮咬(蚊虫能分泌出蚁酸)后,可在患处涂上显碱胜的物质,如:NH3·H2O。
与“(1)在农村,每年冬季因燃烧煤取暖而造成煤气中毒的事故屡见...”考查相似的试题有:
- 下列四个图象分别对应四种操作过程,其中不正确的是( )A.向NaOH溶液中滴加HCl至过量B.向CaCl2溶液中通入CO2气体C.向CuCl...
- 将4.4g二氧化碳气体通入200g氢氧化钠溶液中,恰好完全反应.请通过计算回答下列问题:(1)反应后所得溶液的质量;(2)反应...
- 关于二氧化碳的叙述中正确的是( )A.二氧化碳固体又叫“干冰”,它可以用作制冷剂,也用于人工降雨B.二氧化碳不能供给人们呼...
- 小丽同学对所学部分化学知识归纳如下,其中有错误的一组是[ ]A.B.C.D.
- 能一次鉴别AgNO3、Na2CO3、NaCl三种无色溶液的试剂是A.NaOH溶液B.BaCl2溶液C.盐酸D.硝酸
- 在蔬菜生产过程中,常喷洒农药防治病虫害.据有关专家介绍,用碱性溶液或清水浸泡,可使残留在蔬菜上的农药的毒性降低,因此...
- 人体中一些体液的pH都处在一定的范围内,其中酸性最强的是A.胃液0.8~1.5B.唾液6.5~7.5C.尿液5.0~7.0D.血液7.35~7.45
- 鱼胆弄破后会使鱼肉粘上一种叫胆汁酸(一种酸)的难溶于水的物质,使鱼肉变苦,要清除这种苦味,可用下列何种溶液冲洗最为适宜(...
- 先在A、B、C中选择一个正确选项填在相应的括号内,然后在D处再补充一个符合题意的答案。(1)实验室现有以下6种试剂:氯化钠...
- 下列图像能正确反映其对应关系的是 ( ) A.向一定量pH=3的硫酸溶液中不断加水稀释B.向一定量的饱和石灰水中不断加入生石灰...
 2CO2
2CO2 Cu+CO2
Cu+CO2