本试题 “根据有关信息:2SO2(g)+O2(g)⇌2SO3(g)△H=-196.7kJ/mol;某种硝酸钙晶体可表示为Ca(NO3)2•8H2O;25℃时NaHCO3的溶解度为9.6g/100g水;空气中氧气的体积...” 主要考查您对物质的量浓度
溶解度
化学反应热的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 物质的量浓度
- 溶解度
- 化学反应热的计算
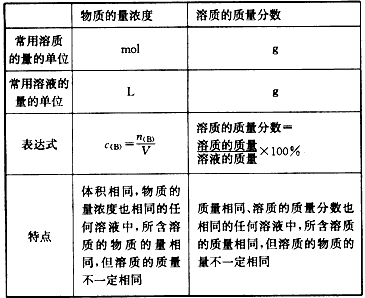
物质的量浓度:
定义:单位体积的溶液里所含溶质B的物质的量,也称为B的物质的量浓度
符号:cB
单位:mol/L(mol·L -1)
计算公式:物质的量浓度(cB)=物质的量(n)/溶液的体积(V)
物质的量浓度与溶液质量分数、密度的关系:c=1000ρω/M
稀释定理:
- 稀释前后溶液中溶质的物质的量不变
c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液) - 稀释前后溶液中溶质的质量不变
ρ(浓溶液)V(浓溶液)w%(浓溶液)=ρ(稀溶液)V(稀溶液)w%(稀溶液)
物质的量浓度与质量分数(质量百分比浓度)的比较:
浓度计算的注意事项:
物质的量浓度(cB)=物质的量(n)/溶液的体积(V)
(1)V指溶液体积而不是溶剂的体积;
(2)取出任意体积的1mol/L溶液,其浓度都是1mol/L。但所含溶质的量则因体积不同而不同;
(3)“溶质”是溶液中的溶质,可以是化合物,也可以是离子或气体特定组合,特别的,像NH3、Cl2等物质溶于水后成分复杂,但求算浓度时,仍以溶解前的NH3、Cl2为溶质,如氨水在计算中使用摩尔质量时,用17g/mol。
溶液中溶质的质量分数与溶质的物质的量浓度的换算:
- 溶液中溶质的质量可以用溶质的质量分数表示: m(溶质)=ρ(g·cm-3)·V(L)·w% (1cm3=1mL)
- 溶液中溶质的质量可以用物质的量浓度来表示: m(溶质)=c(mol/L)·V(L)·M(g·mol-1)
- 由于同一溶液中溶质的质量相等,溶液的体积也相等,但注意:1L=1000mL,所以,上述两式可以联系起来:
ρ(g·cm-3)·1000V(mL)·w%=c(mol/L)·V(L)·M(g·mol-1) 化简得:1000ρw%=cM
溶解度:
(1)固体物质的溶解度:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,单位是g,符号用S表示。
表达式: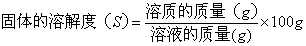
(2)气体的溶解度定义:指该气体在压强为101kPa,一定温度时,溶解在1体积水中达到饱和状态时气体的体积。
溶解度曲线:
- 溶解度曲线由于固体物质的溶解度随温度变化而变化,这种变化可以用溶解度曲线来表示。我们用纵坐标表示溶解度,横坐标表示温度,绘出固体物质的溶解度随温度变化的曲线,这种曲线叫做溶解度曲线。
- 溶解度曲线的意义:
①溶解度曲线上的点表示物质在该点所示温度下的溶解度,溶液所处的状态是饱和溶液。
②溶解度曲线下面的面积上的点,表示溶液所处的状态是不饱和状态,依其数据配制的溶液为对应湿度时的不饱和溶液。
③溶解度曲线上面的面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且该溶质有剩余。
④两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的溶解度相等。
溶解度的影响因素:
- 固体物质溶解度的影响因素:溶质,溶剂的种类,温度
- 气体物质溶解度的影响因素:溶质,溶剂的种类,温度,压强
溶解度与温度的关系:
(1)固体物质的溶解度一般随温度的升高而增大,个别物质反常,如Ca(OH)2。
(2)气体物质的溶解度,一般随温度升高而减小,随压强增大而增大。常见的可溶性气体(常温、常压时的体积数):NH3 (700),HCl(0℃时500),HBr、HI亦易溶,SO2(40),C12 (2).H2S(2.6),CO2(1)。难溶气体:H2、CO、NO。有机物中:HCHO易溶,C2H2微溶,CH4、C2H4难溶。
a.大部分固体物质的溶解度随温度的升高而增大,如KNO3、NaNO3等。
b.少数固体物质的溶解度受温度影响很小,如 NaCl。
c.极少数固体物质的溶解度随温度的升高而减小,如 Ca(OH)2
饱和溶液与不饱和溶液、过饱和溶液:
过饱和溶液:一定温度、压力下,当溶液中溶质的浓度已超过该温度、压力下溶质的溶解度,而溶质仍不析出的现象叫过饱和现象,此时的溶液称为过饱和溶液。
饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得的溶液叫做这种溶质的饱和溶液。
不饱和溶液:在一定温度下,在一定量的溶剂里,还能再溶解某种物质的溶液叫做这种溶质的不饱和溶液。
溶解度曲线:

溶解度曲线的意义:
①表示同一种物质在不同温度时的溶解度;
②表示不同物质在同一温度时的溶解度,可以比较同一温度时,不同物质的溶解度的大小。若两种物质的溶解度曲线相交,则在该温度下两种物质的溶解度相等;
③根据溶解度曲线可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法;
④根据溶解度曲线能进行有关的计算。
溶解度曲线变化规律:
1.大多数固体物质的溶解度随湿度升高而增大,曲线为"陡升型",如硝酸钾。
2.少数固体物质的溶解度受湿度的影响很小,曲线为"缓升型",如氯化钠。
3.极少数固体物质的溶解度随湿度的升高而减小,曲线为"下降型",如氢氧化钙。
4.气体物质的溶解度均随湿度的升高而减小(纵坐标表示体积),曲线也为"下降型",如氧气。
溶解度曲线的应用:
1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性。
2.比较相同湿度时(或一定湿度范围内)不同物质溶解度的大小。
3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法。
4.确定溶液的状态(饱和与不饱和)。

溶解度曲线上的点的意义:
①溶解度曲线上的点表示物质在该点所示温度下的溶解度,溶液所处的状态是饱和溶液。
②溶解度曲线下面的面积上的点,表示溶液所处的状态是不饱和状态,依其数据配制的溶液为对应湿度时的不饱和溶液。
③溶解度曲线上面的面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且该溶质有剩余。
④两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的溶解度相等。
有关溶解度的计算:
某温度下,
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
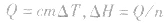
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
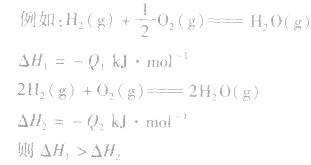
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即
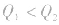 .
.与“根据有关信息:2SO2(g)+O2(g)⇌2SO3(g)△H=-196.7kJ/mol...”考查相似的试题有:
- 已知14mol/L的H2SO4溶液的溶质质量分数为80%,那么7mol/L的H2SO4溶液的溶质量分数将( )A.大于40%B.等于40%C.小于40%D....
- 下列溶液中Cl-浓度最小的是( )A.200mL2mol/LMgCl2溶液B.1000mL2.5mol/LNaCl溶液C.300mL5mol/LKClO3溶液D.250mL1mol/LAl...
- 相同物质的量浓度的(NH4)3PO4、(NH4)2HPO4和NH4H2PO4溶液各200mL,与物质的量浓度为0.2mol/L的氢氧化钠溶液完全反应所需...
- 0.1mol•L-1BaCl2溶液100mL,和0.08mol•L-1AgNO3溶液1000mL充分混合后又加入0.06mol•L-1ZnSO41000mL,最后溶液中浓度最大的离...
- 将标准状况下,V L气体A(摩尔质量为M g•mol-1)溶于0.1L水中,所得溶液密度为ρg•cm-3,求该溶液的:(1)溶质的质量分数;(...
- 现有4.0gNaA,其中含6.02×1022个Na+。(A表示原子或原子团)(1)NaA的相对分子质量为__________。(2)将此NaA完全溶解在46....
- 在一定条件下,CO和CH4燃烧的热化学方程式分别为2CO(g) + O2(g) = 2CO2(g) △H = -566kJ/molCH4(g) + 2O2(g) = CO2(g) + 2H2O(...
- 已知反应:① H2+Cl2=2HCl;② H2+Br2=2HBr。试利用下表中数据进行计算,等物质的量的H2分别与足量的Cl2、Br2反应,反应_____(...
- 将1000 mL 0.1 mol/LBaCl2溶液与足量稀硫酸充分反应放出akJ热量;将1000 mL 0.5 mol/LHCl溶液与足量CH3COONa溶液充分反应放出...
- (1)1.00L 1.00mol/L硫酸溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,写出该反应的热化学方程式______;由...