本试题 “S8分子形成的单斜硫和斜方硫是同素异形体,转化关系 如下S(斜方,固)S(单斜,同) △H=0. 398 kJ·mol-1若NA为阿伏加德罗常数,则下列说法中,不正确的是[ ]...” 主要考查您对阿伏加德罗常数
单质硫
吸热反应、放热反应
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 阿伏加德罗常数
- 单质硫
- 吸热反应、放热反应
阿佛加德罗常数:
1mol粒子集体所含离子数与0.012kg碳12中所含的碳原子数相同,约为6.02×1023。
把1mol任何粒子的粒子数叫阿伏加德罗常数。
符号:NA,通常用6.02×1023mol-1表示
阿佛加德罗常数的单位:
阿佛加德罗常数是有单位的量,其单位是:mol-1,需特别注意。
阿佛加德罗常数的正误判断:
关于阿伏加德罗常数(NA)的考查,涉及的知识面广,灵活性强,是高考命题的热点。解答该类题目时要细心审题,特别注意题目中的关键性字词,留心“陷阱”。主要考查点如下:
1.考查“标准状况”、“常温常压”等外界条件的应用
(1)在标准状况下非气态物质:如H2O、SO3、戊烷、CHCl3、CCl4、苯、乙醇等,体积为22.4L时,其分子数不等于NA。
(2)注意给出气体体积是否在标准状况下:如11.2LH2的分子数未必是0.5NA。
(3)物质的质量、摩尔质量、微粒个数不受外界条件的影响。
2.考查物质的组成
(1)特殊物质中所含微粒(分子、原子、电子、质子、中子等)的数目:如Ne、D2O、18O2、H37Cl、—OH等。
(2)某些物质的阴阳离子个数比:如NaHSO4晶体中阴、阳离子个数比为1∶1,Na2CO3晶体中阴、阳离子个数比为1∶2。
(3)物质中所含化学键的数目:如H2O2、CnH2n+2中化学键的数目分别为3、3n+1。
(4)最简式相同的物质中的微粒数目:如NO2和N2O4,乙烯和丙烯等。
3.考察氧化还原反应中电子转移的数目
如:Na2O2、NO2与H2O的反应;Cl2与H2O、NaOH溶液、Cu或Fe的反应;电解AgNO3溶液、NaCl溶液等。
4.考查弱电解质的电离及盐的水解
如1L0.1mol/L的乙酸溶液和1L0.1mol/L的乙酸钠溶液中的CH3COO-的数目不相等且都小于0.1NA;1L0.1mol/L的NH4NO3溶液中c(NH4+)<0.1mol/L,但含氮原子总数仍为0.2NA;1molFeCl3水解生成Fe(OH)3胶粒的数目远远小于NA。
5.考查一些特殊的反应
如, 1molN2与3H2反应实际生产中得不到2molNH3,因是可逆反应;标准状况下2.24LO2和2.24LNO混合后,由于发生:2NO+O2==2NO2和
1molN2与3H2反应实际生产中得不到2molNH3,因是可逆反应;标准状况下2.24LO2和2.24LNO混合后,由于发生:2NO+O2==2NO2和![]() 两个反应,使2.24L<V<3.36L。
两个反应,使2.24L<V<3.36L。
有关NA的问题中常见的几种特殊情况:
有关NA的问题分析中易忽视如下问题而导致错误:
(1)碳原子超过4个的烃类物质、标准状况下的SO3等均不是气体,不能使用“22.4L/mol”来讨论问题。
(2)Na2O2由Na+和O22-构成,而不是由Na+和O2-构成,阴阳离子个数比为1:2而不是1:1.
(3)SiO2结构中只有原子无分子,1molSiO2中含有共价键数为4NA
硫:
硫是一种非金属元素,化学符号是S,原子序数是16。单质硫是一种非常常见的无臭无味的非金属,纯的硫是黄色的晶体,又称作硫磺。
分子结构:硫元素有多种同素异形体 (由同一种元素形成的性质不同的单质)。若将硫的分子式设为 Sx,则x=1,2,3,4,5,6,7,8,9,10,12,18。Sx的分子结构可用如图表示。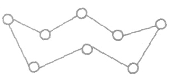
硫的物理性质和化学性质:
(1)物理性质:硫为黄色晶体,俗称硫黄,质脆,易研成粉末。硫的密度比水大,不溶于水,微溶于酒精,易溶于CS。
(2)化学性质:硫位于第3周期ⅥA族,最外层有6个电子,在反应中易得到2个电子而呈-2价;硫的最高正价为+6价;单质硫的化合价为0,处于中间价态,故单质硫既有氧化性又有还原性,在反应中既可作氧化剂又可作还原剂。
如;
①弱氧化性
在加热的条件下,硫黄能被H:和绝大多数的金属单质还原。南于硫的氧化性比较弱,与变价金属反应时往往生成低价态的金属硫化物。例如: 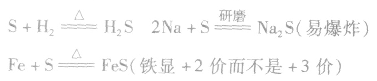

②弱还原性
在一定条件下,硫黄可被F2、O2、Cl2等非金属单质以及一些具有氧化性的化合物氧化,例如:

③硫黄在强碱溶液里加热可发生歧化反应。 (可用热碱液除去试管中残留的硫) 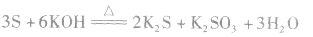
④特性:Hg、Ag在常温下不跟O2反应,但易跟S 反应。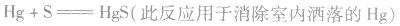
存在与用途:
存在:游离态的硫存在于火山喷口附近或地壳的岩层里,火山喷出物中含有大量含硫化合物,如H2S、 SO2、SO3等。化合态的硫主要以硫化物和硫酸盐的形式存在,如硫铁矿(FeS2)、石膏(CaSO4·2H2O)等。
用途:制H2SO4、黑火药、农药、医药和硫化橡胶。
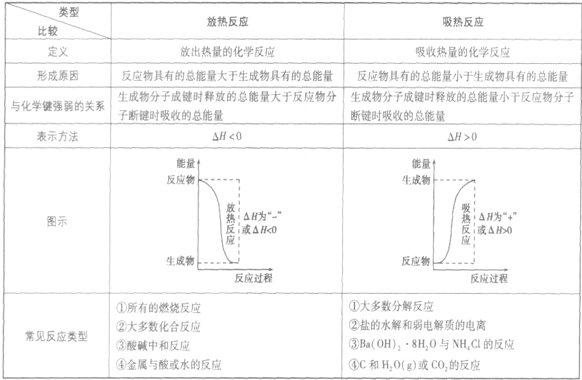
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:
与“S8分子形成的单斜硫和斜方硫是同素异形体,转化关系 如下S(...”考查相似的试题有:
- 若NA为阿伏加德罗常数的值,下列说法中,正确的是( )A.1mol Na2O2与CO2完全反应,转移的电子总数为2NAB.34 g氨气中含有12...
- 下列说法正确的是(NA表示阿伏加德罗常数)____。(1)常温常压下,1mol N2含有NA个氮分子(2)标准状况下,以任意比例混合的甲烷...
- 用NA表示阿伏加德罗常数,下列说法不正确的是( )A.常温常压下,活泼金属从盐酸中置换出1molH2,转移的电子数是2NAB.醋酸...
- 以下物质间的转化通过一步反应都能实现的是[ ]A. HCl→Cl2→HClO→NaClOB. Si→SiO2→H2SiO3→Na2SiO3C. S→SO3→H2SO4→Al2(SO4)3D. N...
- 在空气中加热S粉和Fe粉的混合物,可观察到下列现象:(1)有淡蓝色火焰,且生成刺激性气味的气体。(2)混合粉末变红,放出热...
- 关于非金属元素Cl、Si、S、N的叙述,正确的是 ( )A.在通常情况下其单质均为气体B.其单质均由双原子分子构成C.都有相应的...
- 某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。已知:Na2SO3+H2SO4(浓)Na2SO4+SO2↑+H2O请回答下列问题:(1)...
- 下列说法正确的是 ( )。A.光缆在信息产业中有广泛应用,制造光缆的主要材料是二氧化硅B.金刚石是自然界中硬度最大的物质,...
- 某化学兴趣小组专门研究了氧族元素及其某些化合物部分性质.所查资料信息如下 ①酸性:H2SO4>H2SeO4②氧、硫、硒与氢气化合越来越...
- 下列说法正确的是( )A.废旧电池应集中回收,并填埋处理B.充电电池放电时,电能转变为化学能C.放在冰箱中的食品保质期较...