本试题 “下列说法正确的是[ ]A.其它条件相同时,增大反应物浓度使分子获得能量,活化分子百分数提高,反应速率增大B.判断过程的自发性能确定过程能否发生和过程发生...” 主要考查您对化学反应进行的方向
影响化学反应速率的因素
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应进行的方向
- 影响化学反应速率的因素
化学反应的方向与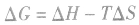 :
:
1.化学反应进行方向的判据
(1)由稳定性弱的物质向稳定性强的物质转变
如 ,稳定性
,稳定性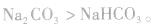
(2)离子反应总是向着使反应体系中某些离子浓度减小的方向进行
①溶解度大的物质向溶解度小的物质转变,如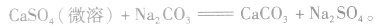
②由相对强酸(碱)向相对弱酸(碱)转变,如 ,
,  所以酸性强弱:
所以酸性强弱: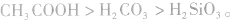
(3)由难挥发性物质向易挥发性物质转变
如 所以沸点:
所以沸点: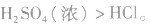
(4)由氧化性(还原性)强的物质向氧化性(还原性)弱的物质转变
如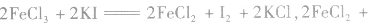
 ,则氧化性:
,则氧化性: 。
。
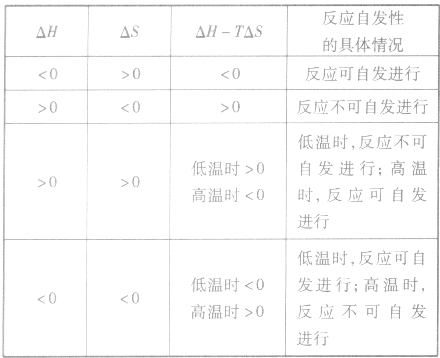
2.焓变和熵变共同判断反应的方向:
在温度、压强一定的条件下,自发反应总是向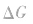
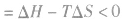 的方向进行,直至达到平衡状态;
的方向进行,直至达到平衡状态;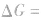
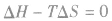 表明反应已达到平衡状态;
表明反应已达到平衡状态;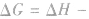
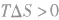 表明反应不能自发进行。
表明反应不能自发进行。
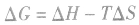 :
:1.化学反应进行方向的判据
(1)由稳定性弱的物质向稳定性强的物质转变
如
 ,稳定性
,稳定性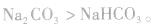
(2)离子反应总是向着使反应体系中某些离子浓度减小的方向进行
①溶解度大的物质向溶解度小的物质转变,如
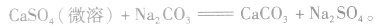
②由相对强酸(碱)向相对弱酸(碱)转变,如
 ,
,  所以酸性强弱:
所以酸性强弱: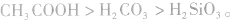
(3)由难挥发性物质向易挥发性物质转变
如
 所以沸点:
所以沸点: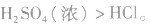
(4)由氧化性(还原性)强的物质向氧化性(还原性)弱的物质转变
如
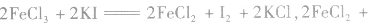
 ,则氧化性:
,则氧化性: 。
。 2.焓变和熵变共同判断反应的方向:
在温度、压强一定的条件下,自发反应总是向
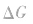
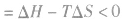 的方向进行,直至达到平衡状态;
的方向进行,直至达到平衡状态;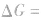
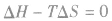 表明反应已达到平衡状态;
表明反应已达到平衡状态;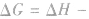
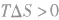 表明反应不能自发进行。
表明反应不能自发进行。
影响化学反应速率的因素:
1.内因:参加反应的物质的结构及性质。
2.外因:主要是指浓度、温度、压强和催化剂,另外还有光、超声波、激光、搅拌、固体表面积、形成原电池等。
(1)浓度:其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。在一定温度下,同体、纯液体的浓度视为定值,如C与CO2的反应、Na与H2O的反应中,C的量和Na、H2O 的量减少并不意味着其“浓度”减小,即不冈其量的增减而影响反应速率,但会因固体表面积的变化而改变反应速率。
(2)温度:其他条件相同时,升高温度,可以加快反应速率,实验测得,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验公式为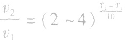
(3)压强:对于气体反应,当温度不变时,增大压强可以加快反应速率。对于气体反应体系,压强改变时有以下几种情况:

(4)催化剂:催化剂是能改变化学反应速率但在反应前后本身的质量和化学性质都不变的物质。对于某些化学反应,使用正催化剂能显著加快化学反应速率。
(5)其他因素:增大同体的表面积(如将块状改为粉末状),可增大反应速率;光照一般也可增大某些反应的速率;形成原电池可以加快反应速率;此外,超声波、放射线、电磁波等因素也能影响反应速率。
3.外因对化学反应速率影响的微观解释
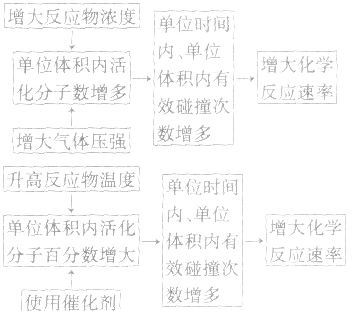
1.内因:参加反应的物质的结构及性质。
2.外因:主要是指浓度、温度、压强和催化剂,另外还有光、超声波、激光、搅拌、固体表面积、形成原电池等。
(1)浓度:其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。在一定温度下,同体、纯液体的浓度视为定值,如C与CO2的反应、Na与H2O的反应中,C的量和Na、H2O 的量减少并不意味着其“浓度”减小,即不冈其量的增减而影响反应速率,但会因固体表面积的变化而改变反应速率。
(2)温度:其他条件相同时,升高温度,可以加快反应速率,实验测得,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验公式为
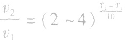
(3)压强:对于气体反应,当温度不变时,增大压强可以加快反应速率。对于气体反应体系,压强改变时有以下几种情况:

(4)催化剂:催化剂是能改变化学反应速率但在反应前后本身的质量和化学性质都不变的物质。对于某些化学反应,使用正催化剂能显著加快化学反应速率。
(5)其他因素:增大同体的表面积(如将块状改为粉末状),可增大反应速率;光照一般也可增大某些反应的速率;形成原电池可以加快反应速率;此外,超声波、放射线、电磁波等因素也能影响反应速率。
3.外因对化学反应速率影响的微观解释

发现相似题
与“下列说法正确的是[ ]A.其它条件相同时,增大反应物浓度使分...”考查相似的试题有:
- 科学家一直致力于研究常温常压下“人工固氮”的新方法,N2在催化剂表面与水发生反应:。该反应在常温常压下能自发进行的主要原...
- 反应CH3OH(l)+NH3(g)→CH3NH2(g)+H2O(g)在某温度时才能自发向右进行,若该反应的△H=17KJ/mol,|△H-T△S|=17kJ/mol,则下列关系...
- 对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3 kJ·mol-1 ΔS=-280.3 kJ·mol-1·K-1,在常温、常压下反...
- 下列判断正确的是[ ]A.0.1 mol·L-1的盐酸和0.1 mol·L-1的醋酸分别与2 mol·L-1的NaOH溶液反应的速率相同B.0.1mol·L-1的HCl和...
- 在密闭容器中进行下列反应时,若保持温度不变,仅增大压强,哪个反应的速率会增大?是正反应速率增大还是逆反应速率增大?或...
- 将等质量的A、B两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装A的试管中加入少量的CuSO4溶液。如下图表示产生氢气的体...
- 从下列实验事实所引起的相应结论不正确的是( )选项实 验 事 实结 论 A其它条件不变,0.01mol/L的KMnO4酸性溶液分别与0.1mol...
- 下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是( )A.10℃3mol/L的盐酸溶液B.20℃2mol/L的盐酸溶液C.10℃4mol...
- 下列有关化学反应速率的说法正确的是A.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢B.100 mL 2 mol/L...
- 2007年国家最高科学技术奖授予石油化工催化剂专家闵恩泽教授,以表彰他在催化剂研究方面做出的突出贡献。下列关于催化剂的说...