本试题 “下列实验现象描述正确的是[ ]A.碘水中加入少量汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色B.红热的铜丝在氯气中燃烧,产生了棕黄色的烟雾C.电解氯化钠...” 主要考查您对单质铜
氯气
氯水
电解饱和氯化钠溶液
分液
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 单质铜
- 氯气
- 氯水
- 电解饱和氯化钠溶液
- 分液
铜元素:
在元素周期表中的位置:铜的原子序数29,位于周期表中第四周期,第IB族。
(1)物理性质:有金属光泽,紫红色固体,密度较大,导电导热性能很好,具有很好的延展性,铜属于重金属、有色金属、常见金属,不能被磁铁吸引。
(2)化学性质: 铜常见的化合价为+1价和+2价
①在加热条件下,铜可与多种非金属单质反应。一般来说,遇到氧化性较弱的非金属,铜显较低化合价;遇到氧化性较强的非金属,铜显较高化合价。例如:与强氧化剂反应(如Cl2 Br2等)生成+2价铜的化合物。如:
Cu+Cl2 CuCl2 2Cu+O2
CuCl2 2Cu+O2 2CuO
2CuO
②铜与酸反应:铜只能被氧化性酸中的中心元素氧化。例如: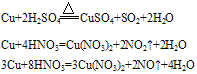
③铜与盐溶液反应:
Cu+2AgCl CuCl2+2Ag
CuCl2+2Ag
铜与铁的对比:
从金属活性顺序表:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au可知,金属铁的金属活性比铜强,所以单质Fe可以从Cu的溶液中还原出单质来,例如: Fe+CuCl2 FeCl2+Cu
FeCl2+Cu
即Fe的还原性强于Cu
铜与浓硫酸和稀硫酸的反应:
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
2Cu+O2+2H2SO4(稀) 2CuSO4+2H2O
2CuSO4+2H2O
注意:从金属活性顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au 可知,铜不能与稀硫酸发生反应,但是在有氧气和加热的条件下可以反应
铜与铜的化合物之间的转换图: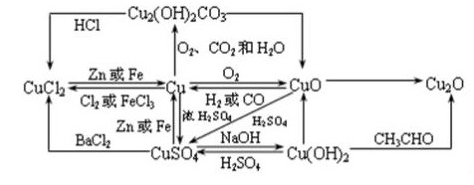
铜的制备和精炼:
(1)工业炼铜法:CuO+CO Cu+CO2
Cu+CO2
(2)湿法炼铜:Fe+CuSO4 FeSO4+Cu
FeSO4+Cu
(3)高温炼铜:工业上用高温冶炼黄铜矿的方法获得铜(粗铜):
2CuFeS2+4O2 Cu2S+3SO2+2FeO(炉渣)
Cu2S+3SO2+2FeO(炉渣)
2Cu2S+3O2 2Cu2O+2SO2
2Cu2O+2SO2
2Cu2O+Cu2S 6Cu+SO2↑
6Cu+SO2↑
备注:粗铜中铜的的含量为99.5%-99.7%,主要含有Ag、Zn、Au等杂质,粗铜通过电解精炼可得到纯度达99.95%-99.98%的铜,原理为用粗铜作阳极,失去电子变为Cu2+,用纯铜棒作阴极即可得精铜。
氯气:
①化学式:Cl2
②氯元素在周期表中的位置:第三周期ⅦA族
③氯原子的电子式: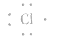
④氯的原子结构示意图: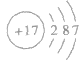
⑤氯原子的外围电子排布式:
⑥化学键类型:非极性共价键
⑦氯分子的电子式:
⑧氯分子的结构式:
氯气的物理性质和化学性质:
(1)物理性质:黄绿色,有刺激性气味,有毒,密度比空气大,能溶于水(1:2)。
(2)化学性质:氯气(Cl2)是双原子分子,原子的最外层有七个电子,是典型的非金属元素,单质是强氧化剂。
①氯气与金属反应: 2Na+Cl2
 2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2
2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2 2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2
2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2 CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。
CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。 ②与非金属的反应 H2+Cl2
 2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2
2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2 2HCl(发生爆炸) 2P+3Cl2
2HCl(发生爆炸) 2P+3Cl2 2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。
2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。 ③与碱反应 Cl2+2NaOH==NaCl+NaClO+H2O 2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
④与某些还原性物质反应:Cl2+2FeCl2===2FeCl3 Cl2+SO2+2H2O==2HCl+H2SO4
⑤有机反应(参与有机反应的取代和加成反应)
CH4+Cl2→CH3Cl+HCl
CH3Cl+Cl2→CH2Cl2+HCl
CH2Cl2+Cl2→CHCl3+HCl
CHCl3+Cl2→CCl4+HCl
Cl2+CH2=CH2→CH2Cl-CH2Cl(加成反应)
⑥与水反应 Cl2+H2O
 HCl+HClO
HCl+HClO 氯水的成分:
新制氯水中存在的分子有盐酸(HCl)、次氯酸(HClO),水(H2O)、还有氯气
氯水的性质:
新制氯水呈黄绿色、有刺激性气味,属于混合物,其所含的多种微粒使氯水的化学性质表现出多重性。
①氯水的Cl2氧化性,只表现氯水的氧化性
A. 在某些含非金属阴离子的溶液中加氯水。
| 氯水滴加溶液 | 反应方程式 | 实验现象 |
| KI溶液 | 2KI+Cl2==2KCl+I2 | 溶液由无色变橙黄色 |
| NaBr溶液 | 2NaBr+Cl2==NaCl+Br2 | 溶液由无色变橙色 |
| K2S溶液 | K2S+Cl2==2KCl+S↓ | 溶液变浑浊 |
| Na2SO3溶液 | Na2SO3+Cl2+H2O==Na2SO4+2HCl | 氯水颜色褪去 |
C. 某些强还原性的气体通入氯水中,氯气将其氧化。
| 通入的气体 | 化学方程式 | 实验现象 |
| H2S | H2S+Cl2==2HCl+S↓ | 溶液出现浑浊 |
| HBr | 2HBr+Cl2==2HCl+Br2 | 溶液由浅黄绿色变橙色 |
| HI | 2HI+Cl2==2HCl+I2 | 溶液由浅黄色变橙黄色 |
| SO2 | SO2+Cl2+2H2O==H2SO4+2HCl | 溶液浅黄色褪去 |
A. 新制氯水滴入NaOH溶液等强碱溶液中,氯水褪色:
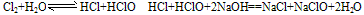
B. 新制氯水中滴加紫色石蕊试液时,溶液先变红色,后褪色,是盐酸的强酸性和次氯酸的强氧化性共同作用的结果。 ③氯水中次氯酸的强氧化性。
新制氯水起漂白作用时,是由于HClO的强氧化性将色素氧化使之褪色的结果,也是Cl2的漂白、杀菌、消毒作用必须有水存在的根本原因。
④氯水中盐酸的强酸性。
在AgNO3溶液中滴加适量的氯水,有白色沉淀生成。是氯水中的HCl与AgNO3作用的结果。
⑤氯水中盐酸的强酸性和氯气的强氧化性共同起作用。
向氯水中加镁粉、铝粉等活泼金属时,可观察到氯水颜色褪去且有气泡冒出,氯水中的Cl2和HCl与镁、铝共同作用的结果。
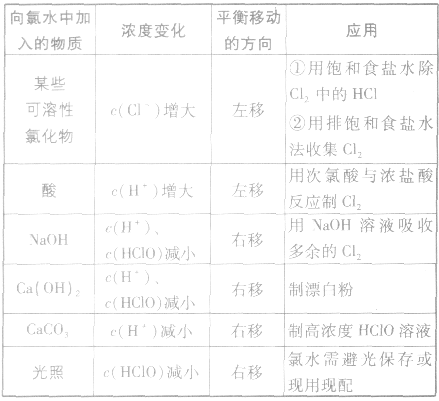
有关氯水问题的分析方法:
1.氯水性质的多样性
氯气溶于水形成的溶液叫氯水,新制的氯水呈浅黄绿色,有刺激性气味。氯水中存在三个平衡:
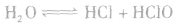 ,
,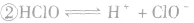 ,
,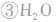
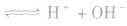 。所以,在氯水中存在三种分子:Cl2、 H2O、HClO;四种离子:H+、Cl-、ClO-及少量OH-。由于在光照条件下HClO可分解
。所以,在氯水中存在三种分子:Cl2、 H2O、HClO;四种离子:H+、Cl-、ClO-及少量OH-。由于在光照条件下HClO可分解
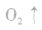 ,故久置的氯水为盐酸。
,故久置的氯水为盐酸。
(1)氯水的性质氯水在与不同物质发生反应时,表现出成分的复杂性和性质的多样性。
说明:
①氯水通常现用现制,可短时间密封保存于棕色试剂瓶中(见光或受热易分解的物质均保存在棕色试剂瓶中);
②Cl:使湿润的蓝色石蕊试纸先变红,后褪色。
(2)新制氯水、久置氯水、液氯的区别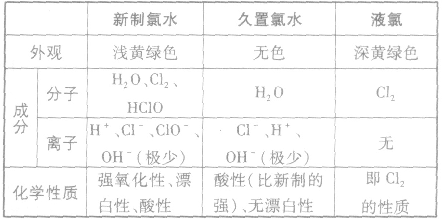
外界因素对平衡 的影响:
的影响:
卤离子的检验方法:
1.银盐法:
特别提醒:加入稀HNO3的目的是防止CO32-、 PO43-等离子的干扰。有关反应为: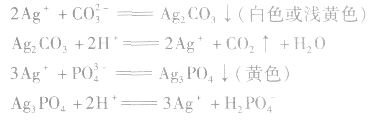
2.置换一萃取法
3.置换一淀粉法检验I-
在小烧杯(或U型管)里装入饱和食盐水,滴入几滴酚酞试液。用导线把碳棒、电池、电流表和铁钉相连(如图)。接通直流电源后,注意观察电流表的指针是否偏转,以及小烧杯内发生的现象,并用湿润的碘化钾淀粉试纸检验阳极放出的气体。
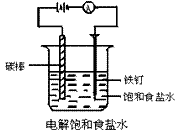
注:粗铁钉要与直流电源的阴极相连,碳棒与阳极相连。
用玻璃棒沾湿润的KI淀粉试纸检验阳极气体。
(1)饱和食盐水电解时,电流表指针发生偏转,阴、阳极均有气体放出,阳极气体有刺激性气味,并能使湿润的KI淀粉试纸变蓝,且阴极区溶液变红。
(2) 阳极:2Cl--2e-==Cl2↑
阴极:2H++2e-==H2↑(或2H2O+2e-==2OH-+H2↑)
总反应式:2NaCl+2H2O
 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑ (3)阴极区溶液变红的原因:这是由于饱和食盐水中,水所电离出的H+在阴极放电,破坏了水的电离平衡
(H2O
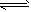 H++OH-)致使阴极区附近溶液中的OH-相对较多,溶液呈碱性,故酚酞变红。
H++OH-)致使阴极区附近溶液中的OH-相对较多,溶液呈碱性,故酚酞变红。 (4)例用电解饱和食盐水溶液可制取氢气、氯气和烧碱。
分液:
| 名称 | 用途 | 装置 | 举例 | 注意事项 |
| 分液 | 分离两种不相混溶的液体(密度不同) | 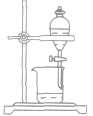 |
水、苯的分离 | 下层液体从下口放出,上层液体从上口倒出 |
与“下列实验现象描述正确的是[ ]A.碘水中加入少量汽油振荡,静置...”考查相似的试题有:
- 氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等.为获得纯净的氧化铜,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下...
- 化学对人类社会进步和发展的贡 献之一是发现和研制了各种材料,例如金属就是我们生活中不可或缺的重要材料, 根据你学过的有...
- 下列气体中,无色无味无毒的是[ ]A.SO2B.CH4C.NOD.Cl2
- 下列关于氯水的叙述,正确的是( )A.新制氯水中只含Cl2和H2O分子B.新制氯水可使蓝色石蕊试纸先变红后褪色C.光照氯水有气...
- 饱和氯水长期放置后,下列微粒数目在溶液中增多的是( )A.Cl2B.HClOC.Cl-D.H2O
- 下列关于氯水的叙述,正确的是A.新制氯水中只含有Cl2、H2O和H+三种微粒B.新制氯水可使蓝色石蕊试纸先变红后褪色C.光照氯水...
- 下列物质中,同时含有氯分子、氯离子和氯的含氧化合物的是[ ]A、氯水B、液氯C、氯酸钾D、次氯酸钙
- 取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入汽油、CCl4、酒精、NaCl溶液,振荡后静置,现象正确的是( )A.Ⅱ中溶液分层...
- 下列说法正确的是[ ]A.仅用AgNO3溶液便可鉴别亚硝酸钠和食盐B.重结晶时,溶液冷却速度越慢得到的晶体颗粒越大C.乙酸与乙醇...
- 下列关于实验原理或操作的叙述中,不正确的是( )A.从碘水中提取单质碘时,不能用无水乙醇代替CCl4B.可用新制的Cu(OH)2...