本试题 “下图中的物质均由前20号元素组成,常温下A为液体,E、G、H、I、J、K、L、M为气体,且G、I、J 为单质;E与M反应的产物是工业上合成某种塑料的单体。(1)A~L中...” 主要考查您对无机推断
极性分子、非极性分子
极性键、非极性键
热化学方程式
电解池电极反应式的书写
氧化还原反应的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 无机推断
- 极性分子、非极性分子
- 极性键、非极性键
- 热化学方程式
- 电解池电极反应式的书写
- 氧化还原反应的计算
无机推断的解题题眼:
1.题眼一:
常见气体单质气体:H2、O2、N2、Cl2(黄绿色)、F2(淡黄绿色)
气态氢化物:NH3(无色有刺激性气味,易液化,极易溶于水,能使湿润的红色石蕊试纸变蓝,遇到HCl形成白烟)
HCl(无色有刺激性气味,极易溶于水,能使湿润的蓝色石蕊试纸变红,在空气中形成白雾,遇到NH3形成白烟)
H2S(无色有臭鸡蛋气味,蛋白质腐败的产物,能溶于水,能使湿润的醋酸铅试纸变黑)
非金属气态氧化物:CO、CO2(直线型非极性分子)、NO(遇到空气变红棕色)、NO2(红棕色,加压、降温会转变成无色N2O4)、SO2(无色、有刺激性气味、能使品红溶液褪色) [固态氧化物]:SO3(无色晶体、易挥发)、P2O5(白色固体、易吸湿,常用作干燥剂)、SiO2(不溶于水、不溶于普通酸的高熔点固体,但溶于氢氟酸和强碱溶液)
气态卤代烃:一氯甲烷(CH3Cl)、氯乙烯(CH2=CHCl)气态醛:甲醛(HCHO)
2.题眼二:
气体溶解性归纳难溶于水的:H2、N2、CO、NO、CH4、C2H4;
微溶于水的:O2、C2H2;
能溶于水的:Cl2(1:1)、H2S(1:2.6)、SO2(1:40);
极易溶于水的:NH3(1:700)、HCl(1:500)、HF、HBr、HI。
3.题眼三:
常见液态物质无机物:液溴Br2、水(H2O)、过氧化氢(H2O2)、二硫化碳(CS2)、三氯化磷(PCl3)
有机物:一般5个碳原子以上的低级烃;除一氯甲烷、氯乙烯之外的低级卤代烃;低级醇;除甲醛之外的低级醛;低级羧酸;低级酯。
4.题眼四:
常见物质的颜色
①红色:Fe(SCN)3(红色溶液); Cu2O(红色固体);Fe2O3(红棕色固体); 液溴(深红棕色);Fe(OH)3(红褐色固体);Cu(紫红色固体);溴蒸气、NO2(红棕色)
②紫色:Fe3+与苯酚反应产物(紫色);I2(有金属光泽紫黑色固体)KMnO4固体(紫黑色);MnO4-(紫红色溶液) 钾的焰色反应(紫色) I2蒸气、I2在非极性溶剂中(紫色)
③橙色:溴水(橙色) K2Cr2O7溶液(橙色)
④黄色:AgI(黄色固体);AgBr(淡黄色固体); FeS2(黄色固体);Na2O2(淡黄色固体);S(黄色固体);I2的水溶液(黄色);Na的焰色反应(黄色);工业浓盐酸(黄色)(含有Fe3+);Fe3+的水溶液(黄色);久置的浓硝酸(黄色)(溶有分解生成的NO2);浓硝酸粘到皮肤上(天然蛋白质)(显黄色);
⑤绿色:Cu2(OH)2CO3(绿色固体);Fe2+的水溶液(浅绿色);FeSO4?7H2O(绿矾);Cl2、氯水(黄绿色);F2(淡黄绿色); CuCl2的浓溶液(蓝绿色);
⑥棕色:FeCl3固体(棕黄色);CuCl2固体(棕色)
⑦蓝色:Cu(OH)2、CuSO4?5H2O、Cu2+在水溶液中(蓝色);淀粉遇I2变蓝色; Cu(OH)2溶于多羟基化合物(如甘油、葡萄糖等)的水溶液中(绛蓝色);
⑧黑色:FeO;Fe3O4;FeS;CuO;CuS;Cu2S;MnO2;C粉;Ag2S;Ag2O;PbS; AgCl、AgBr、AgI、AgNO3光照分解均变黑;绝大多数金属在粉末状态时呈黑色或灰黑色。
⑨白色:常见白色固体物质如下(呈白色或无色的固体、晶体很多):AgCl;Ag2CO3;Ag2SO4;Ag2SO3;BaSO4;BaSO3;BaCO3;CaCO3;MgO;Mg(OH)2;MgCO3;Fe(OH)2;AgOH;PCl5;SO3;三溴苯酚;铵盐(白色固体或无色晶体); Fe(OH)2沉淀在空气中的现象:白色→(迅速)灰绿色→(最终)红褐色
5.题眼五:
根据框图中同一元素化合价的变化为主线,即A→B→C→……型归纳
C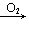 CO
CO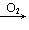 CO2;H2S
CO2;H2S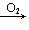 S
S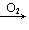 SO2
SO2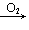 SO3(H2SO4); NH3(N2)
SO3(H2SO4); NH3(N2) NO
NO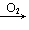 NO2→HNO3; Na
NO2→HNO3; Na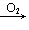 Na2O
Na2O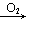 Na2O2; Fe→Fe2+→Fe(OH)2
Na2O2; Fe→Fe2+→Fe(OH)2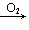 Fe(OH)3;Fe→Fe2+→Fe3+;
Fe(OH)3;Fe→Fe2+→Fe3+;
CH2=CH2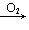 CH3CHO
CH3CHO CH3COOH;CH3CH2OH
CH3COOH;CH3CH2OH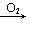 CH3CHO
CH3CHO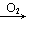 CH3COOH
CH3COOH
6.题眼六:
根据化学反应形式
(1)根据置换反应“单质+化合物=新的单质+新的化合物” 进行推理
㈠金属置换金属
铝热反应:需高温条件才能引发反应的发生,通常用来冶炼一些高熔点金属。如:2Al+Fe2O3 Al2O3+2Fe; 8Al+3Fe3O4
Al2O3+2Fe; 8Al+3Fe3O4 4Al2O3+9Fe
4Al2O3+9Fe
㈡.金属置换非金属
①金属与水反应置换出H2 2Na+2H2O==2Na++2OH-+H2↑ (非常活泼的金属在常温下与H2O反应) 3Fe+4H2O Fe3O4+4H2↑
Fe3O4+4H2↑
②金属与非氧化性酸(或氧化物)反应 2Al+6H+==2Al3++3H2↑;2Mg+CO2 2MgO+C
2MgO+C
㈢.非金属置换非金属
①非金属单质作氧化剂的如:2F2+2H2O==4HF+O2;2FeBr2+3Cl2==2FeCl3+2Br2;X2+H2S==2H++2X-+S↓(X2=Cl2、Br2、I2);2H2S+O2(不足)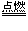 2S+2H2O (H2S在空气中不完全燃烧) 2H2S+O2==2S↓+2H2O(氢硫酸久置于空气中变质)
2S+2H2O (H2S在空气中不完全燃烧) 2H2S+O2==2S↓+2H2O(氢硫酸久置于空气中变质)
②非金属单质作还原剂的如:C+H2O CO+H2 (工业上生产水煤气的反应) Si+4HF==SiF4(易挥发)+2H2↑
CO+H2 (工业上生产水煤气的反应) Si+4HF==SiF4(易挥发)+2H2↑
㈣.非金属置换金属
如:2CuO+C 2Cu+CO2↑
2Cu+CO2↑
①根据反应“化合物+化合物=单质+化合物”进行推理,常见的该类型反应有:
2Na2O2+2H2O==4NaOH+O2↑
2Na2O2+2CO2==2Na2CO3+O2
2H2S+SO2==3S↓+2H2O
KClO3+6HCl(浓)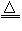 KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O
MnO2+4HCl(浓)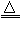 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②根据反应“一种物质三种物质”进行推理,常见该类型的反应有:
Cu2(OH)2CO3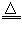 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
2KMnO4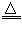 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
NH4HCO3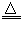 NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
(NH4)2CO3 2NH3↑+CO2↑+H2O
2NH3↑+CO2↑+H2O
NH4HSO3 NH3↑+SO2↑+H2O
NH3↑+SO2↑+H2O
③根据反应“化合物+单质==化合物+化合物+……”,常见该类型的反应有:
Na2SO3+Cl2+H2O==Na2SO4+2HCl
Na2SO3+Br2+H2O==Na2SO4+2HBr
C+4HNO3(浓)==CO2↑+4NO2↑+2H2O
Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
7.题眼七:
根据常见反应的特征现象。
(1)两种物质反应既有沉淀又有气体生成的
①双水解:主要指Al3+、Fe3+与CO32-、HCO3-等之间的双水解
②Ba(OH)2和(NH4)2SO4生成氨气和硫酸钡沉淀
(2)遇水能放出气体的
①Li、Na、K、Ca、Ba、Mg(△)、Fe(高温)[氢后面的金属不跟水反应]
②Na2O2、NaH、CaC2、Al2S3、Mg3N2
③加碱能产生气体的:Al、Si、NH4+
④加酸有沉淀生成的:如SiO32-、AlO2-、S2O32-、C6H5O-(常温下)
⑤有“电解”条件的,通常联想到下列代表物:
a.电解电解质型:不活泼金属的无氧酸盐如CuCl2(aq)
b.放氧生酸型:不活泼金属的含氧酸盐如CuSO4(aq)
c.放氢生碱型:活泼金属的无氧酸盐如NaCl(aq)
d.电解熔融离子化合物:如Al2O3(l)、NaCl(l)
无机推断题的突破方法:
解决无机框图推断题的一般流程是:
整体浏览、寻找突破;
由点到面、广泛联系;
大胆假设、验证确认;
明确要求、规范解答 。
解题的关键是仔细审题,依据物质的特征来寻找突破口,顺藤摸瓜,进而完成全部未知物的推断。常用的突破方法主要有以下几种。
1.依据元素或物质的特征数据突破
常用的有:
(1)在地壳中含量最多的元素是氧;
(2)在地壳中含量最多的金属元素是铝;
(3)组成化合物种类最多的元素是碳;
(4)相对分子质量最小的单质是氢气;
(5)日常生活中应用最广泛的金属是铁。
2.依据物质的特性突破
常用的有:
(1)使淀粉变蓝的是I2;
(2)能使铁、铝钝化的是冷的浓硫酸或浓硝酸;
(3)能与SiO2反应而能雕刻玻璃的是氢氟酸;
(4)能使品红溶液褪色,褪色后的溶液受热后恢复红色的是二氧化硫;
(5)遇SCN-溶液变红色的是Fe3+;
(6)在放电的条件下与氧气化合生成NO的是氮气;
(7)能与水剧烈反应生成氧气的气体是F2;
(8)具有磁性的黑色固体是Fe3O4;
(9)红棕色粉末是Fe2O3;
(10)黄绿色气体是Cl2,红褐色沉淀是Fe(OH)3,能与水反应放出气体的淡黄色粉末是Na2O2。
3.依据物质的特殊用途突破
常用的有:
(1)可作呼吸面具和潜水艇中的供氧剂的是Na2O2;
(2)可用于杀菌、消毒、漂白的物质主要有Cl2、ClO2、NaClO和漂白粉等;
(3)可用作半导体材料、太阳能电池的是晶体硅;
(4)用于制造光导纤维的是SiO2;
(5)可用于治疗胃酸过多的物质是NaHCO3、Al(OH)3等;
(6)可用于制造发酵粉的是NaHCO3;
(7)可用作钡餐的是BaSO4;
(8)可用于焊接钢轨、冶炼难熔金属的是铝热剂;
(9)可用作感光材料的是AgBr;
(10)可用作腐蚀印刷电路板的是FeCl3溶液。
4.依据特殊现象突破
常用的有:
(1)燃烧时产生苍白色火焰的是氢气在氯气中燃烧;
(2)灼烧时火焰呈黄色的是含钠元素的物质;
(3)灼烧时火焰呈紫色(透过蓝色钴玻璃)的是含钾元素的物质;
(4)在空气中迅速由无色变红棕色的气体是NO;
(5)白色沉淀迅速变为灰绿色,最后变为红褐色的是Fe(OH)2转化为Fe(OH)3;
(6)能使湿润的红色石蕊试纸变蓝色的气体是NH3;
(7)使澄清石灰水先变浑浊后变澄清的是CO2、SO2;
(8)加入NaOH溶液先产生白色沉淀后沉淀溶解的溶液中含有Al3+。
5.根据限定条件和解题经验突破
常用的有:
(1)“常见金属”往往是铁或铝;
(2)“常见气体单质”往往是H2、N2、O2、Cl2;
(3)“常用的溶剂”往往是H2O;
(4)“常温常压下为液态”的往往是H2O;
(5)“能与过量HNO3反应”则意味着某元素有变价;
(6)“与浓酸反应”的物质往往是铜、碳、MnO2等;
(7)“电解”生成三种物质的往往为NaCl溶液或CuSO4溶液或AgNO3溶液;“电解”生成两种物质的往往是电解水型的溶液,生成的两种物质为氢气和氧气。熔融电解往往是电解Al2O3、NaCl或MgCl2。
无机物间的特殊转化关系:


二、三角型转化
1.铁三角: 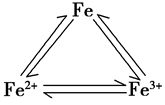
2.铝三角: 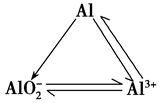
3.氯三角: 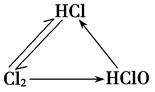
4.硅三角: 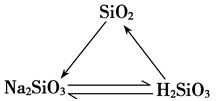
三、交叉型转化关系
1.硫及其重要化合物间的转化 :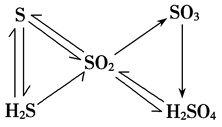
2.氮及其重要化合物间的转化 :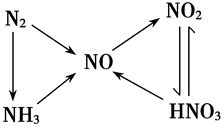
3.钠及其重要化合物间的转化 :



(1)极性分子:正电荷中心和负电荷中心不相重合的分子
(2)非极性分子:正电荷中心和负电荷中心相重合的分子
(3)分子极性的判断:分子的极性由共价键的极性及分子的空间构型两个方面共同决定
非极性分子和极性分子的比较:
| 非极性分子 | 极性分子 | |
| 形成原因 | 整个分子的电荷分布均匀,对称 | 整个分子的电荷分布不均匀、不对称 |
| 存在的共价键 | 非极性键或极性键 | 极性键 |
| 分子内原子排列 | 对称 | 不对称 |

分子极性的判断方法:
An型分子(以非极性键结合形成的单质分子)一般是非极性分子(O3例外),AB型分子一定是极性分子。对于ABn型分子是极性分子还是非极性分子,通常有以下判断方法。
1.根据分子的立体构型判断
判断ABn型分子是否有极性,关键是看分子的立体构型.如果分子的立体构型为直线形、平面三角形、正四面体形、三角双锥形、正八面体形等空间对称的结构,致使正电中心与负电中心重合,这样的分子就是非极性分子。若为V形、三角锥形、四面体形(非正四面体形)等非对称结构,则为极性分子。比如H2O分子中虽然2个H原子轴对称,但整个分子的空间构型是不对称的: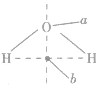 ,负电中心在a点,正电中心在b 点,二者不重合,因此是极性分子。
,负电中心在a点,正电中心在b 点,二者不重合,因此是极性分子。
2.根据实验现象判断
将液体放入适宜的滴定管中,打开活塞让其缓慢流下,将用毛皮摩擦过的橡胶棒靠近液流,流动方向变化(发生偏移)的是极性分子.流动方向不变的是非极性分子。
3.根据中心原子最外层电子是否全部成键判断
ABn型分子中的中心原子A的最外层电子若全部成键(没有孤电子对),此分子一般为非极性分子,如CO2、CCl4等;分子中的中心原子最外层电子若未全部成键(有孤电子对),此分子一般为极性分子,如H2O、 PCl3等。
4.判断ABn型分子极性的经验规律
若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子。如BF3、CO2、CH4、SO3等分子中,B、C、S等元素的化合价的绝对值等于其主族序数,是非极性分子;H2O、 NH3、SO2、PCl3等分子中,O、N、S、P等元素的化合价的绝对值不等于其主族序数,是极性分子。
(1)非极性键:同种元素的原子间形成的共价键(共用电子对不偏移,成键原子双方不显电性)。
如:在非金属单质(H2 Cl2 O2)、共价化合物(H2O2 多碳化合物)、离子化合物(Na2O2 CaC2)中存在。
(2)极性键:不同元素的原子间形成的共价键(共用电子对偏向吸引电子能了强的一方,该元素显负价,偏离吸引电子能力弱的一方,该元素显正价)。如:在共价化合物(HCl H2O CO2 NH3)、某些离子化合物(NaOH Na2SO4 NH4Cl)中存在。
分子空间构型、键的极性与分子的极性:

化学键与物质类别:
1.只含有极性共价键的物质:一般是不同非金属元素构成的共价化合物。例如: 等。
等。
2.只含非极性共价键的物质:同种非金属元素构成的单质。例如: 、金刚石等。
、金刚石等。
3.既有极性键又有非极性键的物质。例如: 等。
等。
4.只含有离子键的物质:活泼非金属元素与活泼金属元素形成的化合物。例如: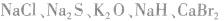 等。
等。
5.既有离子键又有非极性键的物质。例如: 等。
等。
6.既有离子键又有极性键的物质。例如: 等。
等。
7.由离子键、共价键、配位键构成的物质。例如: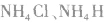 等。
等。
8.只含有共价键而无范德华力的物质。例如:金刚石、晶体硅、 等原子晶体。
等原子晶体。
9.由强极性键构成但又不是强电解质的物质。例如:HF。
10.没有化学键的物质。例如:稀有气体(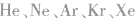 等)。
等)。
1.定义表示反应所放出或吸收热量的化学方程式,叫做热化学方程式。
2.表示意义不仅表明了化学反应中的物质变化,也表明厂化学反应中的能量变化。例如:
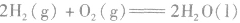 :
: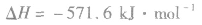 ,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。
,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。热化学反应方程式的书写:
热化学方程式与普通化学方程式相比,在书写时除厂要遵守书写化学方程式的要求外还应注意以下问题:
1.注意△H的符号和单位 △H只能写在标有反应物和生成物状态的化学方程式的右边。若为放热反应,△H为“-”;若为吸热反应,△H为“+”。△H的单位一般为kJ/moJ。
2.注意反应条件反衄热△H与测定条件(温度、压强等)有关。因此书写热化学方程式时应注明△H的测定条件。绝大多数△H是是25℃、101kPa下测定的,此条件下进行的反应可不注明温度和压强。
3.注意物质的聚集状态反应物和生成物的聚集状态不同,反应热△H不同。因此,必须注明物质的聚集状态才能完整地体现出热化学方程式的意义。气体用“g”,液体用:l“,固体用“s”,溶液用“aq”。
4.注意热化学方程式的化学计量数
(1)热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数,因此化学计量数可以是整数,也可以是分数。
(2)热化学方程式中的反应热表示反应已完成时的热量变化,由于△H与反应完成的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,如果化学计量数加倍,则△H也要加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
1.根据装置书写电极反应式
(1)根据电源确定阴、阳两极→确定阳极是否是活性电极→据电极类型及电解质溶液中阴、阳离子的放电顺序写出电极反应式。
(2)在确保阴、阳两极转移电子数目相同的条件下,将两极电极反应式合并即得总反应式。
2.由氧化还原反应方程式书写电极反应式
(1)找出发生氧化反应和还原反应的物质→确定两极名称和生成物→利用电子守恒分别写出两极反应式。
(2)若写出一极反应式,而另一极反应式不好写,可用总反应式减去已写出的电极反应式,即得另一电极反应式。
(1)比较典型的计算有:求氧化剂、还原剂物质的量之比或质量比,计算参加反应的氧化剂货还原剂的量,确定反应前后某一元素的价态变化等。
(2)计算的依据是:氧化剂得电子数等于还原剂失电子数,列出守恒关系式求解。
氧化还原反应的基本规律:
1.守恒规律
氧化还原反应中有物质失电子必有物质得电子,且失电子总数等于得电子总数。或者说氧化还原反应中,有元素化合价升高必有元素化合价降低,且化合价升高总数必等于降低总数。有关得失电子守恒(化合价守恒)的规律有如下应用:
(1)求某一反应中被氧化与被还原的元素原子个数之比,或求氧化剂与还原剂的物质的量之比及氧化产物与还原产物的物质的量之比。
(2)配平氧化还原反应方程式。
(3)进行有关氧化还原反应的计算:
2.强弱规律
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。应用:在适宜条件下,用氧化性较强的物质制备氧化性较弱的物质,或用还原性较强的物质制备还原性较弱的物质,也可用于比较物质间氧化性或还原性的强弱。
3.价态规律
元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要表现一种性质。物质若含有多种元素,其性质是这些元素性质的综合体现。
4.转化规律
氧化还原反应中,以元素相邻价态之间的转化最容易;不同价态的同种元素之间发生反应,元素的化合价只靠近,不交叉;相邻价态的同种元素之间不发生氧化还原反应。如

5.难易规律
越易失去电子的物质,失去后就越难得到电子;越易得到电子的物质,得到后就越难失去电子。一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;同理,一种还原剂同时与多种氧化剂相遇时,氧化性最强的优先发生反应,如向FeBr2溶液中通入Cl2时,发生离子反应的先后顺序为:
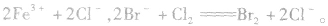 。
。
与“下图中的物质均由前20号元素组成,常温下A为液体,E、G、H、I...”考查相似的试题有:
- 根据下列反应框图填空,已知反应①是工业上生产化合 物D的反应,反应⑤是实验室鉴定化合物E的反应。(1)单质L是______________...
- 下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见...
- (14分)已知蓝铜矿的主要成分是2CuCO3·Cu(OH)2,受热易分解。铝土矿的主要成分是Al2O3、Fe2O3、SiO2。已知NaAlO2+CO2+H2O=Al...
- A、B、C、D、E五种物质都含1~18号元素中的某 一 元素,它们按图所示关系相互转化,已知A为单质.(1)写出A→E的化学式:A___...
- 通常状况下,NC13是一种油状液体,其分子空间构型与氨分子相似,下列对NC13的有关叙述正确的是( )A.CCl4中C-C1键键长比NC1...
- 下列说法中正确的是( )A.在分子中,两个成键的原子间的距离叫键长B.含有极性键的分子一定是极性分子C.键能越大,表示该...
- 20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是...
- 已知化学反应N2+3H2=2NH3的能量变化如图所示,(1)1mol N 和3mol H 生成1mol NH3(g)是__________能量的过程(填“吸收”或“...
- 短周期A,B,C,D,E五种元素原子序数依次增大,A、B同主族,B、C、D三种元素原子形成的金属阳离子电子层结构相同,E元素原子...
- (4分)①某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)===cuSO4+H2。请在下边画出能够...