本试题 “某化学课外活动小组通过实验研究NO2的性质.已知:2NO2+2NaOH═NaNO3+NaNO2+H2O任务1:利用图1所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略...” 主要考查您对一氧化氮
二氧化氮
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 一氧化氮
- 二氧化氮
氮的氧化物:
氮元素有+1、+2、+3、+4、+5五种正价,五种正价对应六种氧化物N2O(俗称“笑气”,具有麻醉作用)、 NO、N2O4(暗蓝色气体)、NO2、N2O4、N2O5(白色固体)。其中N2O3和N2O5分别是HNO2和HNO3的酸酐,它们都是空气污染物,空气中的NO2是造成光化学污染的主要因素。另外,在思考某些问题时,要注意:2NO2 N2O4。对气体体积及平均相对分子质量的影响:
N2O4。对气体体积及平均相对分子质量的影响:
氮元素有+1、+2、+3、+4、+5五种正价,五种正价对应六种氧化物N2O(俗称“笑气”,具有麻醉作用)、 NO、N2O4(暗蓝色气体)、NO2、N2O4、N2O5(白色固体)。其中N2O3和N2O5分别是HNO2和HNO3的酸酐,它们都是空气污染物,空气中的NO2是造成光化学污染的主要因素。另外,在思考某些问题时,要注意:2NO2
 N2O4。对气体体积及平均相对分子质量的影响:
N2O4。对气体体积及平均相对分子质量的影响:一氧化氮的物理性质和化学性质:
(1)物理性质:无色、不溶于水、有毒的气体,密度比空气稍重。
(2)化学性质:
①极易被空气中的O2氧化: 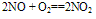
②NO中的氮为+2价,处于中间价态,既有氧化性又有还原性。
二氧化氮的物理性质和化学性质:
(1)物理性质:红棕色、有刺激性气味、有毒的气体,易溶于水、易液化,比空气重。
(2)化学性质:
与H2O反应: 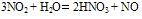
(工业制HNO3原理,在此反应中,NO2同时作氧化剂和还原剂)
NO、NO2的性质、实验室制法的比较:
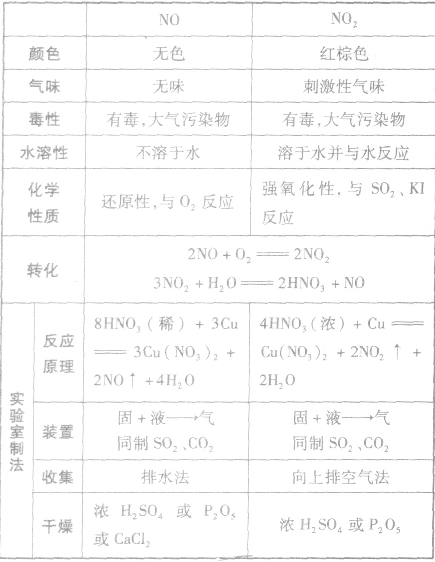
隐含反应: 的应用:
的应用:
通常“纯净”的NO2或N2O4并不纯,因为在常温、常压下能发生反应 ,由于此平衡的存在,导致一些物理量的理论值与实验值有一定的误差。例如:
,由于此平衡的存在,导致一些物理量的理论值与实验值有一定的误差。例如:
1.收集到的1mo1NO2在标准状况下的体积应小于22.4L
2.标准状况下22.4LNO2的质量大于46g。
3.NO与O2混合后,所得物质的相对分子质量应大于按体积比求得的数值。
4.温度影响“ ”平衡体系,其他条件不变,体系颜色随温度改变而改变。升高温度,气体颜色变深;降低温度,气体颜色变浅。
”平衡体系,其他条件不变,体系颜色随温度改变而改变。升高温度,气体颜色变深;降低温度,气体颜色变浅。
5.恒容时,在“ ”平衡体系中增加 N01,相当于增大压强。
”平衡体系中增加 N01,相当于增大压强。
有关混合气体NO、NO2、O2溶于水的计算:
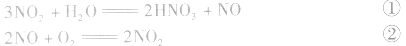
①×2+②得NO2、O2与水反应生成HN3,的化学方程式为: 
①×2+②×3得NO、O2与水反应生成HNO3的化学方程式为: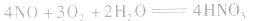
一般NO、NO2、O2与水反应,可归纳成四种情况:
1.NO和NO2混合 剩余气体为NO
剩余气体为NO
2.NO2和O2混合
3.NO和O2混合 
4.NO2、NO、O2的混合
当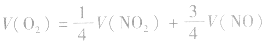 时,反应后无气体剩余
时,反应后无气体剩余
特例:当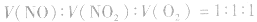 时,无气体剩余。
时,无气体剩余。
发现相似题
与“某化学课外活动小组通过实验研究NO2的性质.已知:2NO2+2NaOH...”考查相似的试题有:
- 现有等体积混合而成的4组气体.①NO2+NO、②NO2+O2、③HCl+N2、④Cl2+SO2.现将其分别通入体积相同的试管中并立即倒立在足量水中...
- 在NO2被水吸收的反应中,发生还原反应和发生氧化反应的物质,其质量比为______.
- 下列推断正确的是[ ]A.SiO2是酸性氧化物,能与NaOH溶液反应B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同C.CO、NO、NO2...
- 某溶液100mL,其中含硫酸0.01mol,硝酸0.04mol,若在该溶液中投入1.92g铜粉微热,反应后放出一氧化氮气体约为A.0.02 molB.0...
- 水是生命之源,也是化学反应中的主角。试回答下列问题:(1)A、B、C是中学化学常见的三种有色物质(其组成元素均属于短周期元...
- 同温同压下,两个等体积的干燥圆底烧瓶中分别充满:①NH3和O2的混合气体,平均相对分子质量为20;②NO2和N2的混合气体,平均相...
- 下列说法中,正确的是( )A.CO、NO都是大气污染物,在空气中都能稳定存B.SiO2是酸性氧化物,能与NaOH溶液反应C.溶液、胶...
- 已知反应:3NO2+H2O═2HNO3+NO,回答下列问题:(1)该反应的离子方程式为______.(2)氧化剂与还原剂的质量比为______,氧化...
- 下列材料最不适宜于储运浓硫酸、浓硝酸的是A.铁 B.铝 C.陶瓷 D.铜
- 依据如图1所示氮元素及其化合物的转化关系,请回答:(1)实验室常用右图装置制取并收集氨气.试管中反应的化学方程式是_____...