本试题 “进行化学实验,观察实验现象.通过分析推理得出正确的结论是化学学习的方法之一.对下列实验操作和事实的解释正确的是( )A.某学生用pH试纸测新制氯水的pH...” 主要考查您对氯气
(浓)硫酸
配制一定物质的量浓度的溶液
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氯气
- (浓)硫酸
- 配制一定物质的量浓度的溶液
氯气:
①化学式:Cl2
②氯元素在周期表中的位置:第三周期ⅦA族
③氯原子的电子式: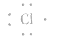
④氯的原子结构示意图: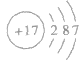
⑤氯原子的外围电子排布式:
⑥化学键类型:非极性共价键
⑦氯分子的电子式:
⑧氯分子的结构式:
氯气的物理性质和化学性质:
(1)物理性质:黄绿色,有刺激性气味,有毒,密度比空气大,能溶于水(1:2)。
(2)化学性质:氯气(Cl2)是双原子分子,原子的最外层有七个电子,是典型的非金属元素,单质是强氧化剂。
①氯气与金属反应: 2Na+Cl2
 2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2
2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2 2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2
2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2 CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。
CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。 ②与非金属的反应 H2+Cl2
 2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2
2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2 2HCl(发生爆炸) 2P+3Cl2
2HCl(发生爆炸) 2P+3Cl2 2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。
2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。 ③与碱反应 Cl2+2NaOH==NaCl+NaClO+H2O 2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
④与某些还原性物质反应:Cl2+2FeCl2===2FeCl3 Cl2+SO2+2H2O==2HCl+H2SO4
⑤有机反应(参与有机反应的取代和加成反应)
CH4+Cl2→CH3Cl+HCl
CH3Cl+Cl2→CH2Cl2+HCl
CH2Cl2+Cl2→CHCl3+HCl
CHCl3+Cl2→CCl4+HCl
Cl2+CH2=CH2→CH2Cl-CH2Cl(加成反应)
⑥与水反应 Cl2+H2O
 HCl+HClO
HCl+HClO 硫酸:
硫酸的分子式:H2SO4;结构式: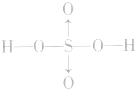 ,H2SO4中硫元素为+6价,处于最 0 高价,具有氧化性,但只有浓H2SO4表现出强氧化性,而稀硫酸、硫酸盐巾的硫元素通常不表现氧化性。
,H2SO4中硫元素为+6价,处于最 0 高价,具有氧化性,但只有浓H2SO4表现出强氧化性,而稀硫酸、硫酸盐巾的硫元素通常不表现氧化性。
硫酸的物理性质和化学性质:
1.硫酸的物理性质
纯硫酸是无色、黏稠的油状液体,密度大,沸点高,是一种难挥发的强酸,易溶于水,能以任意比与水互溶.浓硫酸溶于水时放出大量的热。常见浓硫酸的质量分数为98.3%,其密度为 1.84g·cm-3,沸点为338℃,物质的量浓度为18.4mol·L-1.H2SO4的浓度越大,密度越大,若将30%的H2SO4溶液与10%的H2SO4溶液等体积混合,所得溶液的质量分数大于20%。
2.稀硫酸的化学性质
稀硫酸具有酸的通性。
(1)与指示剂作用:能使紫色石蕊试液变红。
(2)与碱发生中和反应
(3)与碱性氧化物或碱性气体反应 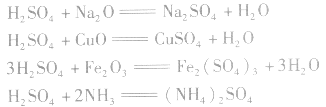
(4)与活泼金属发生置换反应 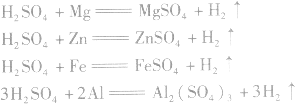
(5)与某些盐溶液反应 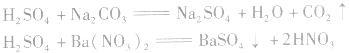
4.浓硫酸的特性
(1)吸水性将一瓶浓硫酸敞口放置在空气中,其质量将增加,密度将减小,浓度降低,体积变大。这是因为浓硫酸具有吸水性,实验室里常利用浓硫酸作干燥剂。
浓硫酸不仅可以吸收空气中的水,还可吸收混在气体中的水蒸气、混在固体中的湿存水、结晶水合物中的部分结晶水。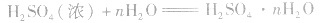 。
。
浓H2SO4中的H2SO4分子可强烈地吸收游离的水分子形成一系列的硫酸水合物: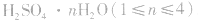 。这些水合物很稳定,所以浓H2SO4可作某些不与其反应的气体、固体的干燥剂,同时不能暴露在空气中。能够用浓H2SO4干燥的气体有
。这些水合物很稳定,所以浓H2SO4可作某些不与其反应的气体、固体的干燥剂,同时不能暴露在空气中。能够用浓H2SO4干燥的气体有 、
、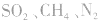 等酸性或中性气体,而具有还原性的气体
等酸性或中性气体,而具有还原性的气体 和碱性气体NH3则不能用浓H2SO4干燥。另外在酯化反应中,如
和碱性气体NH3则不能用浓H2SO4干燥。另外在酯化反应中,如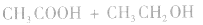
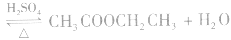 中,浓H2SO4作催化剂和吸水剂。
中,浓H2SO4作催化剂和吸水剂。
(2)脱水性指浓H2SO4将有机物里的氧、氧元素按原子个数比2:1脱去生成水的性质。浓H2SO4从有机物中脱下来的是氢、氧元素的原子,不是水,脱下来的氢、氧元素的原子按2:1的比例结合成H2O;对于分子中所含氢、氧原子个数比为2:l的有机物(如蔗糖、纤维素等),浓H2SO4可使其炭化变黑,如: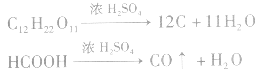
(3)强氧化性常温下,Fe、Al遇浓H2SO4会发生钝化。但热的浓 H2SO4能氧化大多数金属(除金、铂外)、某些非金属单质及一些还原性化合物。如: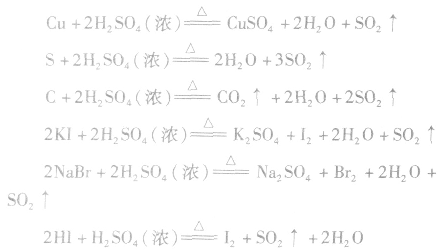
在这些氧化还原反应中,浓硫酸的还原产物一般为SO2。
浓、稀硫酸的比较与鉴别:
1.比较
稀硫酸—弱氧化性—可与活泼金属反应,生成H2—氧化性由H+体现。
浓硫酸——强氧化性——加热时可与绝大多数金属和某些非金属反应,通常生成SO2——氧化性由 体现。
体现。
2.鉴别
从浓H2SO4和稀H2SO4性质的差异人手,可知鉴别浓H2SO4和稀H2SO4的方法有多种。
方法一:取少量蒸馏水,向其中加入少量试样硫酸,如能放出大量热则为浓H2SO4,反之则为稀H2SO4。
方法二:观察状态,浓H2SO4呈黏稠状,而稀H2SO4为黏稠度较小的溶液。
方法三:用手掂掂分量,因为浓H2SO4的密度较大 (1.84g·cm-3,相同体积的浓H2SO4和稀H2SO4,浓H2SO4的质量比稀H2SO4大很多。
方法四:取少量试样,向其中投入铁片,若产生气体,则为稀H2SO4, ;若无明显现象(钝化),则为浓H2SO4。
;若无明显现象(钝化),则为浓H2SO4。
方法五:用玻璃棒蘸取试样在纸上写字,立即变黑 (浓H2SO4的脱水性)者为浓H2SO4,另一种为稀H2SO4。
方法六:取少量试样,分别投入一小块铜片,稍加热发生反应的(有气泡产生)为浓H2SO4。(浓H2SO4的强氧化性),无现象的是稀H2SO4.
硫酸的用途及使用:
(1)用途硫酸是化学工业最黄要的产品之一,它的用途极广(如下图)。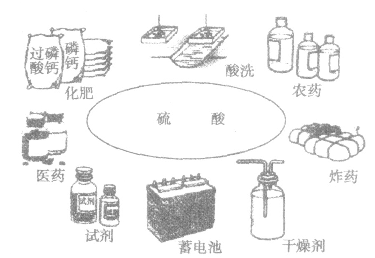
①利用其酸性可制磷肥、氮肥,可除锈,可制实用价值较高的硫酸盐等。
②利用其吸水性,在实验室浓H2SO4常用作干燥剂。
③利用其脱水性,浓H2SO4常作精炼石油的脱水剂、有机反应的脱水剂等。
④利用浓H2SO4的高沸点和难挥发性,常用于制取各种挥发性酸。
⑤浓H2SO4常作有机反应的催化剂。
(2)浓硫酸的安全使用
①浓H2SO4的稀释稀释浓硫酸时应特别注意:将浓硫酸沿器壁慢慢地注入水中,并不断搅拌,使产生的热量迅速地扩散出去。切不可把水倒人浓硫酸里。两种液体混合时,要把密度大的加到密度小的液体中,如浓H2SO4、浓HNO3-混合酸的配制方法是把浓H2SO4沿器壁慢慢地注入浓HNO3中。
②万一不小心将浓硫酸溅到皮肤上、衣服上或桌面上,应分别怎样处理?
皮肤上:用干布迅速拭去,再用大量水冲洗,最后涂上3%~5%的碳酸氢钠溶液。
衣服上:用大量水冲洗。
桌面上:大量时,用适量。NaHCO3,溶液冲洗,后用水冲洗,再用抹布擦干;少量时用抹布擦即可。
(1)仪器:容量瓶(应注明体积),烧杯,量筒,天平,玻璃棒,滴管
(2)原理:c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液)
(3)步骤:
第一步:计算。
第二步:称量:在天平上称量溶质,并将它倒入小烧杯中。
第三步:溶解:在盛有溶质的小烧杯中加入适量蒸馏水,用玻璃棒搅拌,使其溶解。
第四步:移液:将溶液沿玻璃棒注入容量瓶中。
第五步:洗涤:用蒸馏水洗烧杯2~3次,并倒入容量瓶中。
第六步:定容:倒水至刻度线1~2cm处改用胶头滴管滴到与凹液面平直。
第七步:摇匀:盖好瓶塞,上下颠倒、摇匀。
第八步:装瓶、贴签。
(4)误差分析:
①计算是否准确
若计算的溶质质量(或体积)偏大,则所配制的溶液浓度也偏大;反之浓度偏小。
如配制一定浓度的CuSO4溶液,把硫酸铜的质量误认为硫酸铜晶体的质量,导致计算值偏小,造成所配溶液浓度偏小。
②称、量是否无误
如称量NaOH固体在纸上或称量时间过长,会导致NaOH部分潮解甚至变质,有少量NaOH黏附在纸上,造成所配溶液浓度偏低。
量取液体溶质时,俯视或仰视量筒读数,会导致所取溶质的量偏少或偏多,造成所配溶液浓度偏小或偏大。
使用量筒量取液体溶质后再用蒸馏水冲洗量筒,把洗涤液也转入烧杯稀释,或用移液管将液体溶质移入烧杯中后把尖嘴处的残留液也吹入烧杯中。在制造量筒、移液管及滴定管时,已经把仪器内壁或尖嘴处的残留量扣除,所以上述操作均使溶质偏多,造成所配溶液浓度偏大。
③称量时天平未调零
结果不能确定。若此时天平重心偏左,则出称量值偏小,所配溶液的浓度也偏小;若重心偏小,则结果恰好相反。
④称量时托盘天平的砝码生锈
砝码由于生锈而使质量变大,导致称量值偏大,所配溶液的浓度偏高。
⑤操作中溶质有无损失
在溶液配制过程中,若溶质有损失,会使所配溶液浓度偏低。如:⑴溶解(或稀释)溶质,搅拌时有少量液体溅出;⑵未洗涤烧杯或玻璃棒;⑶洗涤液未转入容量瓶;⑷转移洗涤液时有少量液体溅出容量瓶。
影响溶液体积V的操作有:
①定容时不慎加水超过容量瓶的刻度线,再用胶头滴管吸出,使液面重新达到刻度线。当液面超过刻度线时,V偏大使溶液浓度CB已变小,无论是否取出都无法使溶液恢复,只有重新配制。
②定容后盖上瓶塞,摇匀后发现液面低于刻度线,再滴加蒸馏水使液面重新达到刻度线。定容时由于少量溶液粘在瓶颈处没有回流,使液面偏低但溶液浓度未变,若再加水,则使V偏大,cB偏小。
③定容时仰视或俯视
定容时仰视,则液面高于刻度线,V偏大,cB偏小;俯视时液面低于刻度线,V偏小,cB偏大。
④移液或定容时玻璃棒下端放在容量瓶刻度线之上
会导致V偏大,cB偏小。
⑤溶液未冷却至室温即转移入容量瓶
溶解或稀释过程常伴有热效应而使溶液温度升高或降低。容量瓶的使用温度为室温(20℃),若定容时溶液温度高于室温,会使所配溶液浓度偏高;反之浓度偏低。
与“进行化学实验,观察实验现象.通过分析推理得出正确的结论是...”考查相似的试题有:
- 由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实能够支持这个结论的是( )A.已经制得了I2O5等碘的氧化物B.在...
- 下图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为Cl2、E为Fe单质,其余为化合物。它们存在如下转化关系,反应中生...
- 下列推断正确的是 ( )A.根据同浓度的两元素含氧酸钠盐(正盐)溶液的碱性强弱,可判断该两元素非金属性的强弱B.根据同主...
- 下列物质充分反应后,滴入KSCN溶液,溶液呈红色的是[ ]A、FeO+HCl(aq)B、过量的Fe+HNO3(aq)C、FeCl2(aq)+Cl2D、Fe+CuSO...
- 氯水不稳定,要现用现配,下列吸收氯气制备氯水的装置最合理的是
- 下列物质的转化在给定条件下能实现的是[ ]A. ①③⑤B. ②③④C. ②④⑤D. ①④⑤
- 乙二酸和乙二醇在不同条件下反应,会生成三种不同的酯,其中普通酯是一个乙二醇分子跟一个乙二酸分子反应生成的分子式为C4H6O...
- 下列有关实验的叙述正确的是[ ]A.只用水不能鉴别苯和四氯化碳两种有机溶剂B.用广泛pH试纸测得0.10 mol/L(NH4)2CO3溶液的pH=...
- 实验室要配制0.100mol/L的Na2CO3溶液480mL,请回答下列问题:①用天平准确称取Na2CO3固体______g,放入小烧杯中,加适量蒸馏水...
- 配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )A.所用NaOH已吸潮B.定容前溶液未冷却C.称量时砝码...