本试题 “水的电解实验说明:水是由_______________组成的。利用吸附、沉淀、过滤和蒸馏的方法可以使水净化,其中能降低水的硬度的是________;糖水、生理盐水、碘酒是...” 主要考查您对电解水实验
硬水和软水
溶液的定义、组成及特征
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电解水实验
- 硬水和软水
- 溶液的定义、组成及特征
电解原理
电解就是将两根金属或碳棒(即电极)放在要分解的物质(电解质)中,然后接上电源,使电流通过液体。化合物的阳离子移到带负电的电极(阴极),阴离子移到带正电的电极(阳极),化合物分为二极。
电解过程
用电使化合物分解的过程就叫电解过程。
水(H2O)被电解生成电解水。电流通过水(H2O)时,氢气在阴极形成,氧气则在阳极形成。带正电荷的离子向阴极移动,溶于水中的矿物质钙、镁、钾、钠……带正电荷的离子,便在阴极形成,就是我们所喝的碱性水;而带负电的离子,在阴极生成。
电解水实验:
1.实验装置图:
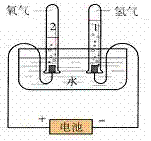
2.表达式:
水 氢气+氧气
氢气+氧气
2H2O 2H2↑+O2↑
2H2↑+O2↑
3.实验现象:
(1)通电后两电极上都有气泡产生;
(2)与电源正极相连接的一端产生的气体比连接负极一端产生的气体少,
接负极一端玻璃管中气体的体积是接正极一端玻璃管内气体体积的2倍。
4.产物检验
(1)正极一端的气体能使带火星的木条复燃,证明气体是氧气。
(2)负极一端的气体能燃烧,并看到微弱的淡蓝色火焰(或听到爆鸣声),
证明气体是氢气。
5.实验结论:
(1)水是由氢元素和氧元素组成的。
(2)1个水分子由2个氢原子和1个氧原子构成。
(3)化学变化中,分子可以再分,原子不可以再分。
6.注意事项:
(1)实验前在水中加入少量的氢氧化钠或者稀硫酸,可增强水的导电性,
加快反应速率。
(2)实验开始时产生的氧气和氢气的体积会小于1:2,是因为氢气难溶于水,
氧气不易溶于水,开始产生的氧气有一部分溶于水,实验时间越长,
其比值越接近1:2。
电解水记忆口诀:
水中通入直流电,正氧负氢会出现;氢二氧一体积比,任何时候都不变。
电解就是将两根金属或碳棒(即电极)放在要分解的物质(电解质)中,然后接上电源,使电流通过液体。化合物的阳离子移到带负电的电极(阴极),阴离子移到带正电的电极(阳极),化合物分为二极。
电解过程
用电使化合物分解的过程就叫电解过程。
水(H2O)被电解生成电解水。电流通过水(H2O)时,氢气在阴极形成,氧气则在阳极形成。带正电荷的离子向阴极移动,溶于水中的矿物质钙、镁、钾、钠……带正电荷的离子,便在阴极形成,就是我们所喝的碱性水;而带负电的离子,在阴极生成。
电解水实验:
1.实验装置图:

2.表达式:
水
 氢气+氧气
氢气+氧气2H2O
 2H2↑+O2↑
2H2↑+O2↑3.实验现象:
(1)通电后两电极上都有气泡产生;
(2)与电源正极相连接的一端产生的气体比连接负极一端产生的气体少,
接负极一端玻璃管中气体的体积是接正极一端玻璃管内气体体积的2倍。
4.产物检验
(1)正极一端的气体能使带火星的木条复燃,证明气体是氧气。
(2)负极一端的气体能燃烧,并看到微弱的淡蓝色火焰(或听到爆鸣声),
证明气体是氢气。
5.实验结论:
(1)水是由氢元素和氧元素组成的。
(2)1个水分子由2个氢原子和1个氧原子构成。
(3)化学变化中,分子可以再分,原子不可以再分。
6.注意事项:
(1)实验前在水中加入少量的氢氧化钠或者稀硫酸,可增强水的导电性,
加快反应速率。
(2)实验开始时产生的氧气和氢气的体积会小于1:2,是因为氢气难溶于水,
氧气不易溶于水,开始产生的氧气有一部分溶于水,实验时间越长,
其比值越接近1:2。
电解水记忆口诀:
水中通入直流电,正氧负氢会出现;氢二氧一体积比,任何时候都不变。
定义:
硬水是含有较多可溶性钙、镁化合物的水。
软水是不含或含较少可溶性钙、镁化合物的水。
水的硬度:
水的硬度常用一种规定的标准来衡量,这个标准是:把1L水里含10mgCaO(或相当于10mgCaO)称为1度。
硬水和软水的检验:
(1)用肥皂水来检验硬水和软水,把肥皂水滴在水里搅拌,产生泡沫多的是软水,产生泡沫少或不产生泡沫的是硬水
(2)用加热煮沸的方法检验硬水和软水。水加热煮沸时,有较多沉淀的是硬水,不产生沉淀或者产生沉淀较少的是软水。
硬水的软化:
就是设法除去硬水中的钙、镁化合物。
硬水软化的方法:生活中常用煮沸法,工业上常用离子交换法和药剂软化法,实验室常用蒸馏法,蒸馏法是净化程度较高的水,蒸馏时应注意以下几点:
①蒸馏瓶中的液体不能超过其容积的2/3.
②加热时,应在烧瓶中放几粒沸石(或碎瓷片)。
③装置气密性良好
④水银温度计的水银球应放在蒸馏烧瓶的支管口附近。
使用硬水造成的危害:
饮用水中含有微量的钙、镁成分,对人体健康是有益的。但是,水中含太多的钙、镁成分,对生活和生产都有危害。
①用硬水洗涤,不仅浪费肥皂,而且会在织物上积有肥皂跟钙、镁反应后生成的沉淀,不容易洗干净,还会使纤维变脆、易断。
②硬水有苦涩味,长期饮用硬水会使人的胃肠功能紊乱,出现不同程度的腹胀、腹泻和腹痛。
③锅炉用水硬度太大,会产生水垢,这会大大降低锅炉的导热能力,造成燃料的浪费。另外,当水垢爆裂脱落时,会造成炉壁局部受热不均,易引起锅炉爆炸。
离子交换法:
离子交换法是工业生产软化水的重要方法之一。离子交换法的原理:离子交换树脂是一种聚合物,带有相应的功能基团(一般情况下,常规的钠离子交换树脂带有大量的钠离子),当含钙、镁离子较高的硬水经过离子交换树脂时,离子交换树脂即可以释放出钠离子,其功能基团与钙、镁离子结合。这样水中的钙、镁离子含量下降,水的硬度降低,硬水即可被软化为软水。离子交换法的流程为:工作(即交换)、反洗、再生、清洗四个过程。
硬水是含有较多可溶性钙、镁化合物的水。
软水是不含或含较少可溶性钙、镁化合物的水。
水的硬度:
水的硬度常用一种规定的标准来衡量,这个标准是:把1L水里含10mgCaO(或相当于10mgCaO)称为1度。
硬水和软水的检验:
(1)用肥皂水来检验硬水和软水,把肥皂水滴在水里搅拌,产生泡沫多的是软水,产生泡沫少或不产生泡沫的是硬水
(2)用加热煮沸的方法检验硬水和软水。水加热煮沸时,有较多沉淀的是硬水,不产生沉淀或者产生沉淀较少的是软水。
硬水的软化:
就是设法除去硬水中的钙、镁化合物。
硬水软化的方法:生活中常用煮沸法,工业上常用离子交换法和药剂软化法,实验室常用蒸馏法,蒸馏法是净化程度较高的水,蒸馏时应注意以下几点:
①蒸馏瓶中的液体不能超过其容积的2/3.
②加热时,应在烧瓶中放几粒沸石(或碎瓷片)。
③装置气密性良好
④水银温度计的水银球应放在蒸馏烧瓶的支管口附近。
使用硬水造成的危害:
饮用水中含有微量的钙、镁成分,对人体健康是有益的。但是,水中含太多的钙、镁成分,对生活和生产都有危害。
①用硬水洗涤,不仅浪费肥皂,而且会在织物上积有肥皂跟钙、镁反应后生成的沉淀,不容易洗干净,还会使纤维变脆、易断。
②硬水有苦涩味,长期饮用硬水会使人的胃肠功能紊乱,出现不同程度的腹胀、腹泻和腹痛。
③锅炉用水硬度太大,会产生水垢,这会大大降低锅炉的导热能力,造成燃料的浪费。另外,当水垢爆裂脱落时,会造成炉壁局部受热不均,易引起锅炉爆炸。
离子交换法:
离子交换法是工业生产软化水的重要方法之一。离子交换法的原理:离子交换树脂是一种聚合物,带有相应的功能基团(一般情况下,常规的钠离子交换树脂带有大量的钠离子),当含钙、镁离子较高的硬水经过离子交换树脂时,离子交换树脂即可以释放出钠离子,其功能基团与钙、镁离子结合。这样水中的钙、镁离子含量下降,水的硬度降低,硬水即可被软化为软水。离子交换法的流程为:工作(即交换)、反洗、再生、清洗四个过程。
溶液的概念:
一种或几种物质分散到另一种物质中,形成均一的,稳定的混合物,叫做溶液
溶液的组成:
(1)溶液由溶剂和溶质组成溶质:被溶解的物质溶剂:
溶液质量=溶剂质量+溶质质量
溶液的体积≠溶质的体积+溶剂的体积
(2)溶质可以是固体(氯化钠、硝酸钾等)、液体(酒精、硫酸等)或气体(氯化氢、二氧化碳等),一种溶液中的溶质可以是一种或多种物质。水是最常用的溶剂,汽油、洒精等也可以作为溶剂,如汽油能够溶解油脂,洒精能够溶解碘等。
溶液的特征:
均一性:溶液中各部分的性质都一样;
稳定性:外界条件不变时,溶液长时间放置不会分层,也不会析出固体溶质
对溶液概念的理解:
溶液是一种或儿种物质分散到另一种物质里.形成的均一、稳定的混合物。应从以下几个方面理解:
(1)溶液属于混合物;
(2)溶液的特征是均一、稳定;
(3)溶液中的溶质可以同时有多种;
(4)溶液并不一定都是无色的,如CuSO4溶液为蓝色;
(5)均一、稳定的液体并不一定郡是溶液,如水;
(6)溶液不一定都是液态的,如空气。
溶液与液体
(1)溶液并不仅局限于液态,只要是分散质高度分散(以单个分子、原子或离子状态存在)的体系均称为溶液。如锡、铅的合金焊锡,有色玻璃等称为固态溶液。气态的混合物可称为气态溶液,如空气。我们通常指的溶液是最熟悉的液态溶液,如糖水、盐水等。
(2)液体是指物质的形态之一。如通常状况下水是液体,液体不一定是溶液。
3. 溶液中溶质、溶剂的判断
(1)根据名称。溶液的名称一般为溶质的名称后加溶剂,即溶质在前,溶剂在后。如食盐水中食盐是溶质,水是溶剂,碘酒中碘是溶质,酒精是溶剂。
(2)若是固体或气体与液体相互溶解成为溶液。一般习惯将固体或气体看作溶质,液体看作溶剂。
(3)若是由两种液体组成的溶液,一般习惯上把量最多的看作溶剂,量少的看作溶质。
(4)其他物质溶解于水形成溶液时。无论,水量的多少,水都是溶剂。
(5)一般水溶液中不指明溶剂,如硫酸铜溶液,就是硫酸铜的水溶液,蔗糖溶液就是蔗糖的水溶液,所以未指明溶剂的一般为水。
(6)物质在溶解时发生了化学变化,那么在形成的溶液中,溶质是反应后分散在溶液中的生成物。如 Na2O,SO3分别溶于水后发生化学反应,生成物是 NaOH和H2SO4,因此溶质是NaOH和H2SO4,而不是 Na2O和SO3;将足量锌粒溶于稀硫酸中所得到的溶液中,溶质是硫酸锌(ZnSO4),若将蓝矾(CuSO4·5H2O) 溶于水,溶质是硫酸铜(CuSO4),而不是蓝矾。
溶液的导电性:
探究溶液导电性的实验:
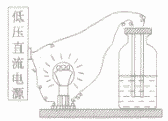
用如图所示的装置试验一些物质的导电性。可以养到蒸馏水、乙醉不导电,而盆酸、硫酸、氢氧化钠溶液、氢氧化钙溶液、氯化钠溶液、碳酸钠溶液均能导电。
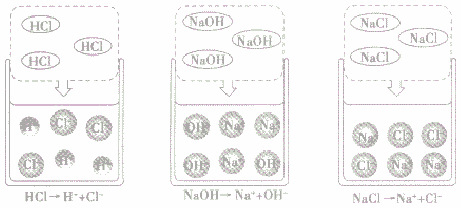
酸、碱、盐溶液导电的原因:
酸、碱、盐溶于水,在水分子作用下,电离成自由移动的带正(或负)电的阳(或阴)离子(如下图所示)。因此酸、碱、盐的水溶液都能导电,导电的原因是溶液中存在自由移动的离子,而蒸馏水和乙醇中不存在自由移动的离子。
发现相似题
与“水的电解实验说明:水是由_______________组成的。利用吸附、...”考查相似的试题有:
- (2011四川宜宾,12题)2011年3月日本发生9.0级大地震,造成数百万人饮水困难。完成下列各题:⑴化学式H2O的意义是 (答一点...
- 2012年3月22日是第二十届”。水与人类的生活和生产密切相关。(1)节约用水、防止水污染应成为我们的自觉行为。下列有关叙述中不...
- 关于水的说法中正确的是 ( )A.水由一个氧元素和两个氢元素组成B.水由氢原子和氧原子构成C.水由氢元素和氧元素组成D.水...
- (1)长期饮用硬水对人体的健康不利,要降低水的硬度,我采用______ 的方法.(2)对于①沉淀、②蒸馏、③过滤等 净化水的操作中...
- 化学就在我们身边,与我们的生活息息相关.请回答下列生活中的化学问题.(1)“沙里淘金”说明黄金在自然界中能够以______(填...
- 下图所示,小朋友在用硬水洗衣服时,为何如此表情?请你帮助分析原因。
- 水是一种重要的分散剂,当物质被水分散时,会形成不同的体系.物质被水分散形成溶液的特征是______.溶液是由溶质和溶剂组成...
- 对于一杯食盐溶液,下列说法正确的是[ ]A、上面比下面咸B、下面又上面咸C、各部分一样咸D、无法判断
- 下列物质中,属于溶液的是 ( )A.牛奶B.蒸馏水C.石灰乳D.生理盐水
- 20℃时,某物质R的不饱和溶液中溶质的质量分数为10%,若向该溶液中再加入5g R或蒸发掉32.26g水,都可以形成饱和溶液.那么该物...