本试题 “下列关于烧碱的制备、性质及其应用的表述错误的是( )A.电解饱和食盐水制烧碱的离子方程式为:2Cl-+2H2O 电解 . 2OH-+H2↑+Cl2↑B.1807年英国科学家戴维通过...” 主要考查您对电解池原理
实验中的事故处理
化学实验安全
氯碱工业
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电解池原理
- 实验中的事故处理
- 化学实验安全
- 氯碱工业
电解池:
(1)电解:使电流通过电解质溶液且在阴、阳极两极引起氧化还原反应的过程叫电解。
(2)装置:电解池(电解槽)
(3)特点:将电能转化为化学能。
形成条件:①与电源相连的两个电极,②电解质溶液或熔融电解质,③形成闭合回路
(4)阴离子放电顺序:S2->I->Br->Cl->OH->SO42->NO3->F- 阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
(5)电解时溶液pH值的变化规律电解质溶液在电解过程中,有时溶液pH值会发生变化。判断电解质溶液的pH值变化,有时可以从电解产物上去看。
①若电解时阴极上产生H2(消耗H+),阳极上无O2产生,电解后溶液pH值增大;
②若阴极上无H2,阳极上产生O2,则电解后溶液pH值减小;
③若阴极上有H2,阳极上有O2,且(相当于电解水),则有三种情况:
a如果原溶液为中性溶液,则电解后pH值不变;
b如果原溶液是酸溶液,则pH值变小;
c如果原溶液为碱溶液,则pH值变大;
④若阴极上无H2,阳极上无O2产生,电解后溶液的pH可能也会发生变化。如电解CuCl2溶液(CuCl2溶液由于Cu2+水解显酸性),一旦CuCl2全部电解完,pH值会变大,成中性溶液。
(6)电解反应类型:从参加反应的物质来分电解反应可分成五类:
①H2O型:实质是电解水。如电解硝酸钠、氢氧化钠、硫酸等溶液。
②溶质型:溶质所电离出来的离子发生氧化还原,如电解氯化铜、溴化氢等溶液。
③硫酸铜溶液型:电解产物是金属、氧气与酸。如电解硫酸铜溶液生成单质铜、氧气和硫酸,电解硝酸银溶液时生成单质银、氧气和硝酸。
④氯化钠溶液型:电解产物是非金属单质、氢气与碱。如电解氯化钠溶液时生成氯气、氢气和氢氧化钠,电解溴化钾溶液时生成溴单质、氢气和氢氧化钾。
⑤电镀型:镀层金属作阳极,阳极反应是:M-ne-=Mn+,镀件作阴极,阴极反应是:Mn++ne-=M。(电解精炼与电镀,实质上是相同的)
(1)电解:使电流通过电解质溶液且在阴、阳极两极引起氧化还原反应的过程叫电解。
(2)装置:电解池(电解槽)
(3)特点:将电能转化为化学能。
形成条件:①与电源相连的两个电极,②电解质溶液或熔融电解质,③形成闭合回路
(4)阴离子放电顺序:S2->I->Br->Cl->OH->SO42->NO3->F- 阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
(5)电解时溶液pH值的变化规律电解质溶液在电解过程中,有时溶液pH值会发生变化。判断电解质溶液的pH值变化,有时可以从电解产物上去看。
①若电解时阴极上产生H2(消耗H+),阳极上无O2产生,电解后溶液pH值增大;
②若阴极上无H2,阳极上产生O2,则电解后溶液pH值减小;
③若阴极上有H2,阳极上有O2,且(相当于电解水),则有三种情况:
a如果原溶液为中性溶液,则电解后pH值不变;
b如果原溶液是酸溶液,则pH值变小;
c如果原溶液为碱溶液,则pH值变大;
④若阴极上无H2,阳极上无O2产生,电解后溶液的pH可能也会发生变化。如电解CuCl2溶液(CuCl2溶液由于Cu2+水解显酸性),一旦CuCl2全部电解完,pH值会变大,成中性溶液。
(6)电解反应类型:从参加反应的物质来分电解反应可分成五类:
①H2O型:实质是电解水。如电解硝酸钠、氢氧化钠、硫酸等溶液。
②溶质型:溶质所电离出来的离子发生氧化还原,如电解氯化铜、溴化氢等溶液。
③硫酸铜溶液型:电解产物是金属、氧气与酸。如电解硫酸铜溶液生成单质铜、氧气和硫酸,电解硝酸银溶液时生成单质银、氧气和硝酸。
④氯化钠溶液型:电解产物是非金属单质、氢气与碱。如电解氯化钠溶液时生成氯气、氢气和氢氧化钠,电解溴化钾溶液时生成溴单质、氢气和氢氧化钾。
⑤电镀型:镀层金属作阳极,阳极反应是:M-ne-=Mn+,镀件作阴极,阴极反应是:Mn++ne-=M。(电解精炼与电镀,实质上是相同的)
原电池、电解池、电镀池的比较:


实验过程中常见意外事故的处理方法:
(1)割伤:取出伤口中的玻璃或固体物,用蒸馏水洗后涂上红药水,用绷带扎住或敷上创可贴药膏。大伤口则应先按紧主血管以防止大量出血,急送医院治疗。
(2)烫伤:轻轻涂以玉树油或鞣酸油膏,重伤涂以烫伤油膏后送医院。
(3)试剂灼伤
①酸:立即用大量水洗,再以3%-5%的碳酸氢钠溶液洗,最后用水洗。严重时要消毒,拭干后涂烫伤油膏。
②碱:立即用大量水洗,再以1%-5%硼酸液洗,最后用水洗。严重时同上处理。
③溴:立即用大量水洗,再以酒精檫至无溴液存在为止,然后涂上甘油或烫伤油膏。
④钠:可见的小块用镊子移去,其余与碱灼伤处理相同。
(4)试剂或异物溅入眼内:任何情况下都要先洗涤,急救后送医院。
①酸:用大量水洗,再以1%的碳酸氢钠溶液洗。
②碱:用大量水洗,再以1%硼酸液洗。
③溴:用大量水洗,再以1%的碳酸氢钠溶液洗。
④玻璃:用镊子移去碎玻璃,或在盆中用水洗,切勿用手揉动。
(5)中毒:溅入口中尚未咽下者应立即吐出,再用大量的水清洗口腔,如已吞下者,应根据毒物的性质给以解毒剂,可内服一杯含有5~10cm3稀硫酸铜溶液的温水,再用手指伸入咽喉部促使呕吐,并立即送医院。
(6)不渗触电时,立即切断电源,必要时进行人工呼吸,找医生抢救。
(7)起火:要立即切断电源,并采取适当的措施防止火势扩展。
(1)割伤:取出伤口中的玻璃或固体物,用蒸馏水洗后涂上红药水,用绷带扎住或敷上创可贴药膏。大伤口则应先按紧主血管以防止大量出血,急送医院治疗。
(2)烫伤:轻轻涂以玉树油或鞣酸油膏,重伤涂以烫伤油膏后送医院。
(3)试剂灼伤
①酸:立即用大量水洗,再以3%-5%的碳酸氢钠溶液洗,最后用水洗。严重时要消毒,拭干后涂烫伤油膏。
②碱:立即用大量水洗,再以1%-5%硼酸液洗,最后用水洗。严重时同上处理。
③溴:立即用大量水洗,再以酒精檫至无溴液存在为止,然后涂上甘油或烫伤油膏。
④钠:可见的小块用镊子移去,其余与碱灼伤处理相同。
(4)试剂或异物溅入眼内:任何情况下都要先洗涤,急救后送医院。
①酸:用大量水洗,再以1%的碳酸氢钠溶液洗。
②碱:用大量水洗,再以1%硼酸液洗。
③溴:用大量水洗,再以1%的碳酸氢钠溶液洗。
④玻璃:用镊子移去碎玻璃,或在盆中用水洗,切勿用手揉动。
(5)中毒:溅入口中尚未咽下者应立即吐出,再用大量的水清洗口腔,如已吞下者,应根据毒物的性质给以解毒剂,可内服一杯含有5~10cm3稀硫酸铜溶液的温水,再用手指伸入咽喉部促使呕吐,并立即送医院。
(6)不渗触电时,立即切断电源,必要时进行人工呼吸,找医生抢救。
(7)起火:要立即切断电源,并采取适当的措施防止火势扩展。
预防事故发生的措施:
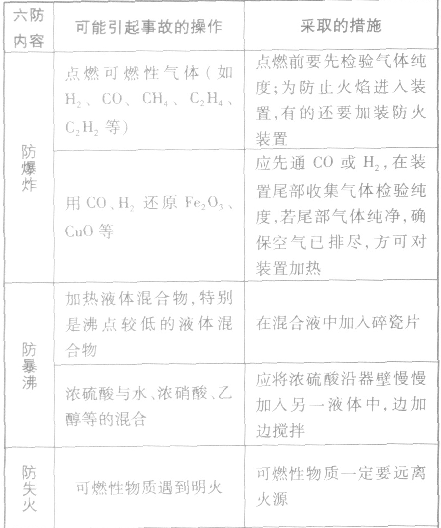
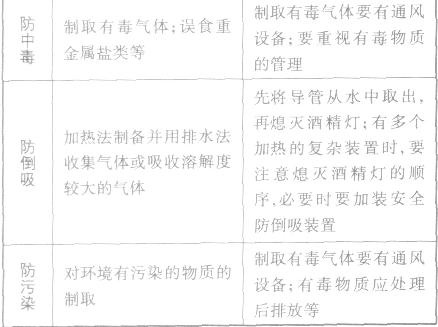
化学实验安全原则:
(1)遵守实验室规则。
(2)了解安全措施。
(3)掌握正确的操作方法。
(4)重视并逐渐熟悉污染物和废弃物的处理方法。
化学实验安全总结:
(1)给试管里的固体加热,应先将试管干燥或使试管均匀受热,这样可以防止加热过程中试管炸裂。
(2)给试管里的液体加热时,试管不能直立。应与桌面成45°角,并且试管内的液体不要超过试管容积的1/3,更不能将试管对着有人的方向,这样可以防止加热过程中液体沸腾冲出烫伤人。
(3)使用酒精灯的过程中,不能向燃着的灯内添加酒精,也不能用酒精灯引燃另一只酒精灯,这样做可避免失火。
(4)用酒精灯加热烧杯中的液体时,应垫上石棉网,可防止烧坏受热不均炸裂。
(5)蒸发溶液时,应用玻璃棒不断搅拌,这样做可避免液体受热不均溅出伤人。
(6)点燃可燃性气体如H2、CH4、CO前一定要检验它们的纯度,这样做可防止不纯气体点燃发生爆炸。
(7)做CO还原CuO实验时,在加热之前应先通入CO,这样做可赶跑空气,防止装置内CO与空气混合受热时爆炸,同时还要进行尾气处理,防止CO污染空气。
(8)用KMnO4和KClO3制O2时,要注意药品中不要混有可燃物,否则有引起试管爆炸的危险。
(9)用KMnO4制O2时,不要忘记在试管口塞一团棉花,否则加热时KMnO4粉末会溅入导管内堵塞导管,从而使试管炸裂。
(10)加热某些固体药品制取氧气,并用排水法收集结束时,应先将导管移出水槽,然后再熄灭酒精灯,这样做可防止水槽中的水倒流到试管,使热的试管炸裂。
(11)白磷等易燃物应保存在水中,用后不能随意丢弃,因为白磷着火点较低,易发生缓慢氧化而自燃。这样做可避免发生火灾。
(12)做探究燃烧条件的实验时,白磷的燃烧应在通风橱内进行。
(13)稀释浓硫酸时,一定要将浓硫酸慢慢注入水中,并用玻璃棒不断搅拌,切不可将水倒入浓硫酸中。这样可防止水浮在酸液上方,沸腾后溅出造成事故。
(14)蒸馏时,可在烧瓶中加入几粒沸石或碎瓷片,这样可防止液体暴沸。
(1)遵守实验室规则。
(2)了解安全措施。
(3)掌握正确的操作方法。
(4)重视并逐渐熟悉污染物和废弃物的处理方法。
化学实验安全总结:
(1)给试管里的固体加热,应先将试管干燥或使试管均匀受热,这样可以防止加热过程中试管炸裂。
(2)给试管里的液体加热时,试管不能直立。应与桌面成45°角,并且试管内的液体不要超过试管容积的1/3,更不能将试管对着有人的方向,这样可以防止加热过程中液体沸腾冲出烫伤人。
(3)使用酒精灯的过程中,不能向燃着的灯内添加酒精,也不能用酒精灯引燃另一只酒精灯,这样做可避免失火。
(4)用酒精灯加热烧杯中的液体时,应垫上石棉网,可防止烧坏受热不均炸裂。
(5)蒸发溶液时,应用玻璃棒不断搅拌,这样做可避免液体受热不均溅出伤人。
(6)点燃可燃性气体如H2、CH4、CO前一定要检验它们的纯度,这样做可防止不纯气体点燃发生爆炸。
(7)做CO还原CuO实验时,在加热之前应先通入CO,这样做可赶跑空气,防止装置内CO与空气混合受热时爆炸,同时还要进行尾气处理,防止CO污染空气。
(8)用KMnO4和KClO3制O2时,要注意药品中不要混有可燃物,否则有引起试管爆炸的危险。
(9)用KMnO4制O2时,不要忘记在试管口塞一团棉花,否则加热时KMnO4粉末会溅入导管内堵塞导管,从而使试管炸裂。
(10)加热某些固体药品制取氧气,并用排水法收集结束时,应先将导管移出水槽,然后再熄灭酒精灯,这样做可防止水槽中的水倒流到试管,使热的试管炸裂。
(11)白磷等易燃物应保存在水中,用后不能随意丢弃,因为白磷着火点较低,易发生缓慢氧化而自燃。这样做可避免发生火灾。
(12)做探究燃烧条件的实验时,白磷的燃烧应在通风橱内进行。
(13)稀释浓硫酸时,一定要将浓硫酸慢慢注入水中,并用玻璃棒不断搅拌,切不可将水倒入浓硫酸中。这样可防止水浮在酸液上方,沸腾后溅出造成事故。
(14)蒸馏时,可在烧瓶中加入几粒沸石或碎瓷片,这样可防止液体暴沸。
氯碱工业:
1.离子交换膜法电解制碱的主要生产流程可以简单表示如下图所示:

电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙,精制食盐水时经常进行以下措施
(1)过滤海水
(2)加入过量氢氧化钠,去除钙、镁离子,过滤 Ca2++2OH-=Ca(OH)2(微溶) Mg2++2OH-=Mg(OH)2↓
(3)加入过量氯化钡,去除硫酸根离子,过滤 Ba2++SO42-=BaSO4↓
(4)加入过量碳酸钠,去除钙离子、过量钡离子,过滤 Ca2++CO32-=CaCO3↓ Ba2++CO32-=BaCO3↓
(5)加入适量盐酸,去除过量碳酸根离子 2H++CO32-=CO2↑+H2O
(6)加热驱除二氧化碳
(7)送入离子交换塔,进一步去除钙、镁离子
(8)电解 2NaCl+2H2O H2↑+Cl2↑+2NaOH 离子交换膜法制碱技术,具有设备占地面积小、能连续生产、生产能力大、产品质量高、能适应电流波动、能耗低、污染小等优点,是氯碱工业发展的方向。
H2↑+Cl2↑+2NaOH 离子交换膜法制碱技术,具有设备占地面积小、能连续生产、生产能力大、产品质量高、能适应电流波动、能耗低、污染小等优点,是氯碱工业发展的方向。
2.以氯碱工业为基础的化工生产
NaOH、Cl2和H2都是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于各工业。所以氯碱工业及相关产品几乎涉及国民经济及人民生活的各个领域。
由电解槽流出的阴极液中含有30%的NaOH,称为液碱,液碱经蒸发、结晶可以得到固碱。阴极区的另一产物湿氢气经冷却、洗涤、压缩后被送往氢气贮柜。阳极区产物湿氯气经冷却、干燥、净化、压缩后可得到液氯。
2NaOH+Cl2=NaCl+NaClO+H2O H2O+Cl2=HCl+HClO H2+Cl2=2HCl 2NaOH+CO2=Na2CO3(苏打)+H2O NaOH+CO2=NaHCO3(小苏打)
随着人们环境保护意识的增强,对以氯碱工业为基础的化工生产过程中所造成的污染及其产品对环境造成的影响越来越重视。
1.离子交换膜法电解制碱的主要生产流程可以简单表示如下图所示:

电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙,精制食盐水时经常进行以下措施
(1)过滤海水
(2)加入过量氢氧化钠,去除钙、镁离子,过滤 Ca2++2OH-=Ca(OH)2(微溶) Mg2++2OH-=Mg(OH)2↓
(3)加入过量氯化钡,去除硫酸根离子,过滤 Ba2++SO42-=BaSO4↓
(4)加入过量碳酸钠,去除钙离子、过量钡离子,过滤 Ca2++CO32-=CaCO3↓ Ba2++CO32-=BaCO3↓
(5)加入适量盐酸,去除过量碳酸根离子 2H++CO32-=CO2↑+H2O
(6)加热驱除二氧化碳
(7)送入离子交换塔,进一步去除钙、镁离子
(8)电解 2NaCl+2H2O
 H2↑+Cl2↑+2NaOH 离子交换膜法制碱技术,具有设备占地面积小、能连续生产、生产能力大、产品质量高、能适应电流波动、能耗低、污染小等优点,是氯碱工业发展的方向。
H2↑+Cl2↑+2NaOH 离子交换膜法制碱技术,具有设备占地面积小、能连续生产、生产能力大、产品质量高、能适应电流波动、能耗低、污染小等优点,是氯碱工业发展的方向。 2.以氯碱工业为基础的化工生产
NaOH、Cl2和H2都是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于各工业。所以氯碱工业及相关产品几乎涉及国民经济及人民生活的各个领域。
由电解槽流出的阴极液中含有30%的NaOH,称为液碱,液碱经蒸发、结晶可以得到固碱。阴极区的另一产物湿氢气经冷却、洗涤、压缩后被送往氢气贮柜。阳极区产物湿氯气经冷却、干燥、净化、压缩后可得到液氯。
2NaOH+Cl2=NaCl+NaClO+H2O H2O+Cl2=HCl+HClO H2+Cl2=2HCl 2NaOH+CO2=Na2CO3(苏打)+H2O NaOH+CO2=NaHCO3(小苏打)
随着人们环境保护意识的增强,对以氯碱工业为基础的化工生产过程中所造成的污染及其产品对环境造成的影响越来越重视。
发现相似题
与“下列关于烧碱的制备、性质及其应用的表述错误的是( )A.电...”考查相似的试题有:
- CuSO4溶液是中学化学及工农业生产中常见的一种试剂.(1)某同学配制CuSO4溶液时,需加入一定量的硫酸溶液,用离子方程式说明...
- 由碳棒、铁片和200mL稀H2SO4(足量)组成的原电池中,当在碳棒上共放出3.36L(标准状况)气体时,求消耗铁多少克?有多少个电...
- 下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极...
- (1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_________________。A.C(s)...
- 用惰性电极电解下列溶液,起始时在阳极上不能生成O2的是( )A.KNO3B.Na2SC.Ba(OH)2D.H2SO4
- 下图所示为实验室中完成不同的化学实验所选用的装置或进行的操作,其中没有明显错误的是测定中和热用石灰石和稀盐酸制取CO2蒸...
- 下列仪器在使用之前需要检查是否漏液的是①分液漏斗 ②容量瓶 ③长颈漏斗 ④普通漏斗A.①②B.①②③C.②③④D.①②③④
- 下列实验能获得成功的是A.用酸性高锰酸钾溶液鉴别正己烷和乙醇B.用分液漏斗分离乙醛和水C.用苯、溴水和铁粉混合制取溴苯D...
- 下列有关物质存放方法错误的是A.金属钠存放于煤油中B.漂白粉长期放置在烧杯中C.铝片长期放置在不密封的纸盒里D.FeSO4溶液...
- 下列装置或操作能达到实验目的的是A.排水集气法收集NOB.用滴瓶长期保存NaOH溶液C.实验室制取乙酸乙酯D.石油的分馏