本试题 “室温下,下列关于pH均为9、体积均为10 mL 的NaOH溶液和CH3COONa溶液的比较说法正确的是[ ]A.两种溶液中的c(Na+)相等B.分别加热到相同温度时,CH3COONa溶液...” 主要考查您对强电解质电离(氯化钠、硫酸氢钠等物质的电离)
盐水解的影响因素
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 强电解质电离(氯化钠、硫酸氢钠等物质的电离)
- 盐水解的影响因素
强电解质电离:
强电解质在溶液中完全电离,且符号为“=”,如NaCl=Na++Cl-、NaHSO4==Na++H++SO42-
强电解质在溶液中完全电离,且符号为“=”,如NaCl=Na++Cl-、NaHSO4==Na++H++SO42-
酸与碱反应的几种情况:
1.等体积、等物质的量浓度的酸 混合
混合 
2.等体积的酸 混合
混合 
3.若酸 等体积混合溶液呈中性
等体积混合溶液呈中性 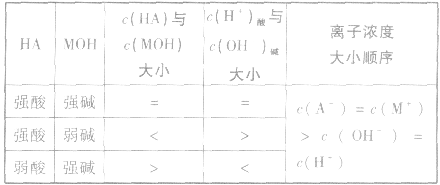
4.强酸溶液(pH=a)与强碱溶液(pH=b)完全中和时的体积比

影响盐类水解平衡的因素:
主要因素是盐本身的性质,组成的盐的酸根对应的酸越弱(或阳离子对应的碱越弱),水解程度就越大,另外还受温度、浓度及外加酸碱等因素的影响。
(1)温度:盐的水解是吸热反应,因此升高温度水解程度增大;
(2)浓度:盐的浓度越小,水解程度越大,但溶液的酸碱性一般越弱;
(3)外加酸碱:外加酸碱能促进或抑制盐的水解,使盐的水解程度降低,但由于酸(或碱)的加入,使溶液的酸(碱性)增强。
例如: 外界条件对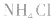 水解平衡
水解平衡
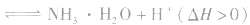 的影响
的影响
(4)能水解的阳离子与能水解的阴离子混合,会相互促进水解。常见的含下列离子的两种盐混合时,会发生较彻底的双水解反应:阳离子:Fe3+、Al3+;阴离子:CO32-、HCO3-、S2-、HS-、AlO2-、SO32-、HSO3-等。
(5)Fe3+与S2-、HS-、SO32-、HSO3-等还原性离子发生氧化还原反应,而不是发生双水解反应。
(6)HCO3-与AlO2-在溶液中也不能共存,可发生反应产生白色沉淀,但不是由于双水解反应,而是:
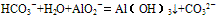
主要因素是盐本身的性质,组成的盐的酸根对应的酸越弱(或阳离子对应的碱越弱),水解程度就越大,另外还受温度、浓度及外加酸碱等因素的影响。
(1)温度:盐的水解是吸热反应,因此升高温度水解程度增大;
(2)浓度:盐的浓度越小,水解程度越大,但溶液的酸碱性一般越弱;
(3)外加酸碱:外加酸碱能促进或抑制盐的水解,使盐的水解程度降低,但由于酸(或碱)的加入,使溶液的酸(碱性)增强。
例如: 外界条件对
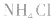 水解平衡
水解平衡
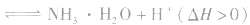 的影响
的影响
(4)能水解的阳离子与能水解的阴离子混合,会相互促进水解。常见的含下列离子的两种盐混合时,会发生较彻底的双水解反应:阳离子:Fe3+、Al3+;阴离子:CO32-、HCO3-、S2-、HS-、AlO2-、SO32-、HSO3-等。
(5)Fe3+与S2-、HS-、SO32-、HSO3-等还原性离子发生氧化还原反应,而不是发生双水解反应。
(6)HCO3-与AlO2-在溶液中也不能共存,可发生反应产生白色沉淀,但不是由于双水解反应,而是:
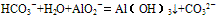
盐类水解程度大小比较规律:
1.盐水解生成的弱酸(或弱碱)越弱,水解程度越大。常据此判断弱酸(或弱碱)的相对强弱:如等浓度的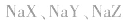 三种盐溶液,pH依次增大,则弱酸根离子
三种盐溶液,pH依次增大,则弱酸根离子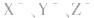 的水解程度依次增大,所以酸性HX>HY>HZ。
的水解程度依次增大,所以酸性HX>HY>HZ。
2.相同条件下:正盐>相应酸式盐。如水解程度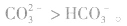
3.相互促进水解的盐>单水解的盐>相互抑制水解的盐。如水解程度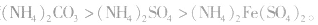
发现相似题
与“室温下,下列关于pH均为9、体积均为10 mL 的NaOH溶液和CH3COO...”考查相似的试题有:
- 下列关于0.2mol/L的Ba(NO3)2溶液不正确的说法是( )A.500mL溶液中NO3-物质的量为0.2NAB.500mL溶液中NO3-离子浓度为0.4mo...
- 下列说法中正确的是( ) A.硫酸钡难溶于水,但硫酸钡属于强电解质 B.氯化钠水溶液在电流的作用下电离出Na+和Cl- C.硫酸钠...
- 下列关系式中不正确的是A.0.1mol/LNH4Cl溶液中:c(Cl—)>c(NH4+)>c(H+)>c(OH—)B.0.1mol/L Na2S溶液中:c(Na+)>2c(S2—)C.0.1...
- 如图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③...
- 下列说法正确的是 A.pH=2和pH=1的硝酸中c(H+)之比为1:10B.Na2CO3溶液c(Na+)与c(CO)之比为2:1C.0.2 mol/L与0.1 mol/L...
- 根据化学平衡知识,判断下列说法正确的是( )A.已知NaHA溶液呈弱碱性,则该溶液中下列各种微粒浓度大小排列顺序为:c(Na+)...
- 已知常温下:PH(NaHCO3)>7>PH(NaHSO3)。则在NaHCO3或NaHSO3溶液中,有关微粒的物质的量浓度表示式一定正确的是(X表示S或C...
- (4分)盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏可以降低土壤的碱性。试用化学方程式分别表示盐碱地产生...
- (10分)铁酸钠(Na2FeO4)是一种新型水处理剂,它有比高锰酸钾更强的氧化性,在水中反应被还原为Fe3+。(1)铁酸钠中铁元素...
- (6分)某溶液经检测只含有NH4+、Cl-、H+、OH-四种离子,(1)若该溶液中只有一种溶质,则该溶质是 (写化学式)。(2)若该...