本试题 “(1)写出下列物质发生水解反应的离子方程式,并指出水溶液的酸碱性:①NaHS_________________②NaHPO4_________________③CH3COONH4_________________④NaHSO3__...” 主要考查您对水解方程式
双水解
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 水解方程式
- 双水解
水解方程式:
1、定义:表示盐水解的式子。
2、书写水解方程式的注意事项:
(1)找出盐类组成中会发生水解的离子(弱酸阴离子或弱碱阳离子),直接写出盐类水解的离子方程式。
(2)盐类的水解反应是中和反应的逆反应,中和反应的程度很大,水解反应的程度很小,故写盐类的水解反应方程式或离子方程式时,一般不写“=”而写“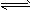 ”。
”。
(3)一般盐类水解的程度很小,水解产物也少,通常不生成沉淀或气体,也不发生分解。在书写盐类水解的离子方程式时一般不标“↑”或“↓”,也不把生成物(如NH3·H2O、H2CO3)写成其分解产物的形式。
(4)多元弱酸的盐中弱酸根离子分步水解,第一步比较容易发生,第二步比第一步难。水解时以第一步为主。多元弱酸的水解反应式应分步书写,而多元弱碱的水解反应不分步书写。
(5)某些盐溶液在混合时,由于一种盐的阳离子和另一种盐的阴离子都能发生水解,水解后溶液的性质相反,它们在一起时就能相互促进对方的水解,使两种离子的水解趋于完全。称为双水解。如:铝盐和碳酸盐混合:
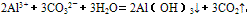 ,双水解反应中如果有复分解反应的条件(沉淀、气体、水等生成),则反应比较完全。书写时一般用“=”,标“↑”或“↓”。
,双水解反应中如果有复分解反应的条件(沉淀、气体、水等生成),则反应比较完全。书写时一般用“=”,标“↑”或“↓”。
1、定义:表示盐水解的式子。
2、书写水解方程式的注意事项:
(1)找出盐类组成中会发生水解的离子(弱酸阴离子或弱碱阳离子),直接写出盐类水解的离子方程式。
(2)盐类的水解反应是中和反应的逆反应,中和反应的程度很大,水解反应的程度很小,故写盐类的水解反应方程式或离子方程式时,一般不写“=”而写“
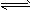 ”。
”。 (3)一般盐类水解的程度很小,水解产物也少,通常不生成沉淀或气体,也不发生分解。在书写盐类水解的离子方程式时一般不标“↑”或“↓”,也不把生成物(如NH3·H2O、H2CO3)写成其分解产物的形式。
(4)多元弱酸的盐中弱酸根离子分步水解,第一步比较容易发生,第二步比第一步难。水解时以第一步为主。多元弱酸的水解反应式应分步书写,而多元弱碱的水解反应不分步书写。
(5)某些盐溶液在混合时,由于一种盐的阳离子和另一种盐的阴离子都能发生水解,水解后溶液的性质相反,它们在一起时就能相互促进对方的水解,使两种离子的水解趋于完全。称为双水解。如:铝盐和碳酸盐混合:
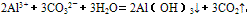 ,双水解反应中如果有复分解反应的条件(沉淀、气体、水等生成),则反应比较完全。书写时一般用“=”,标“↑”或“↓”。
,双水解反应中如果有复分解反应的条件(沉淀、气体、水等生成),则反应比较完全。书写时一般用“=”,标“↑”或“↓”。盐类水解方程式的书写:
一般来说,盐类水解的程度不大,应该用可逆号“ ”表示,盐类水解一般不会产生沉淀和气体,所以不用“↑”“↓”符号表示。
”表示,盐类水解一般不会产生沉淀和气体,所以不用“↑”“↓”符号表示。
1.一元弱酸的强碱盐和一元弱碱的强酸盐的水解。 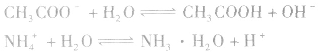
2.多元弱酸的强碱盐的水解是分步进行的,不能合并,以第一步为主。 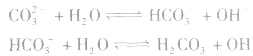
3.多元弱碱的强酸盐的水解。 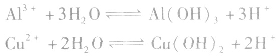
4.弱酸的铵盐的水解。 
5.完全双水解的离子间的反应用“==”表示,标明“↑”“↓”符号。如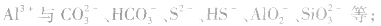


双水解:
当弱酸的酸根与弱碱的阳离子同时存在于水溶液中时,弱酸的酸根水解生成的氢氧根离子与弱碱的阳离子水解生成的氢离子反应生成水而使两种离子的水解平衡向水解方向移动而互相促进水解,而水解完全。
当弱酸的酸根与弱碱的阳离子同时存在于水溶液中时,弱酸的酸根水解生成的氢氧根离子与弱碱的阳离子水解生成的氢离子反应生成水而使两种离子的水解平衡向水解方向移动而互相促进水解,而水解完全。
发现相似题
与“(1)写出下列物质发生水解反应的离子方程式,并指出水溶液的...”考查相似的试题有:
- 室温下,0.01 mol/L 二元酸H2A溶液的pH= 3,下列说法正确的是A.在Na2A,NaHA两种溶液中,离子种类相同B.NaHA溶液的pH一定大...
- 下列物质的水溶液能在蒸发皿中加热浓缩到原物质的是 ( )①NaAlO2②FeCl3③明矾 ④绿矾 ⑤KNO3⑥H2S ⑦HCl ⑧蛋白质 ⑨Na2SO3⑩CaCl2A...
- 下列说法正确的是 A.pH=2和pH=1的硝酸中c(H+)之比为1:10B.Na2CO3溶液c(Na+)与c(CO)之比为2:1C.0.2 mol/L与0.1 mol/L...
- 物质的量浓度、体积都相同的NaF和NaCN溶液中,离子总数的关系正确的是(已知HF比HCN易电离)A.NaF=NaCNB.NaF>NaCNC.NaF...
- 下列方程式书写正确的是[ ]A.HCO3-在水溶液中的电离方程式:HCO3-+H2OH3O++CO32-B.H2SO3的电离方程式H2SO32H++SO32-C.C...
- 下列溶液中,粒子浓度关系正确的是A.0.1mol/L的Na2S溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S)B.醋酸钠溶液与盐酸混合之后...
- 在盐类发生水解的过程中正确的说法是( )A.盐的电离平衡被破坏B.水的电离程度逐渐增大C.溶液的pH一定发生改变D.抑制了水的...
- 在室温下,下列五种溶液①0.1mol/LNH4Cl ②0.1mol/LCH3COONH4 ③0.1mol/ L NH4HSO4 ④0.1mol/LNH3·H2O和0.1mol/LNH4Cl的混合溶液 ...
- 物质的量浓度相同的三种一元酸的钠盐NaX、NaY、NaZ溶液的pH 分别为8、9、10,则这三种一元酸的酸性由强到弱的顺序为A.HX>HY...
- 把NaHCO3作为发酵粉使用时,往往加入少量的明矾,这是因为 ( )A.明矾起催化作用B.硫酸铝钾比碳酸氢钠更易分解C.明矾受热分...