本试题 “极少数青少年有吸烟的坏习惯.香烟燃烧的烟气中有许多强致癌物质,其中对人体危害最大的是尼古丁[C10H14N2]、焦油、一氧化碳等,下列说法错误的是( )A.吸...” 主要考查您对化学元素和人体健康
物质组成元素的质量比
元素的定义
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学元素和人体健康
- 物质组成元素的质量比
- 元素的定义
在人体中元素的存在形式:
①碳、氢、氧、氮主要以水、糖类、蛋白质、维生素和脂肪的形式存在。
②其他的元素主要以无机盐的形式存在于水溶液中。
③钙元素主要以羟基磷酸钙[Ca10(PO4)6(OH)2] 晶体的形式存在。
常量元素:
常量元素人体中含量较多的元素有11种,它们约占人体质量的99.95%。在人体中含量超过0.01%的元素,称为常量元素。
①人体中的常量元素
| 元素名称 | 元素符号 | 质量分数% |
| 氧 | O | 65.0 |
| 碳 | C | 18.0 |
| 氢 | H | 10.0 |
| 氮 | N | 3.0 |
| 钙 | Ca | 2.0 |
| 磷 | P | 1.0 |
| 钾 | K | 0.35 |
| 硫 | S | 0.25 |
| 钠 | Na | 0.15 |
| 氯 | Cl | 0.15 |
| 镁 | Mg | 0.05 |
②一些常量元素在人体中的作用及每天适宜摄入量
| 钙 | 使骨骼和牙街具有坚硬的结构支架 | 800—1200mg | 缺钙主要影响骨骼的发育和结构,临床症状表现为青少年的佝偻病和成年人的骨质软化症及老年人的骨质疏松症。钙是无毒的元素,但摄入过量会导致高血钙,从而引起消化系统、泌尿系统等的疾病 | 海产品、豆类、奶类、各种绿叶蔬菜等 | 其中99%存在于骨骼和牙齿中,主要以羟基磷酸钙 [Ca10(PO4)6(OH)2晶体的形式存在 |
| 钠 | 细胞外液和细胞内液中的Na+和K+各自保持一定的浓度,维持人体内的水分和体液恒定的pH | 2000—2500mg | 缺钠会引起肌肉痉挛、头痛等;过量会引起水肿、高血压、贫血等 | 食盐 | 其中一半以Na+的形式存在于细胞外液中 |
| 钾 | 1850—5600mg | 缺钾会引起肌肉不发达、心律小齐等;过量会导致恶心、腹泻等 | 香蕉、柑橘、橙子、山楂、蘑菇、豆炎及其制品等 | 主要以K+的形式萍在干细胞内液中 | |
| 镁 | 促进骨骼发育、细胞遗传物质合成等 | 300—400mg | 缺镁会引起肌肉不发达、抽搐、痉挛、心律不齐等;过量会引起神经系统紊乱、肾病等 | 坚果、大豆、牛奶等 | 70%的镁以磷酸盐和碳酸盐形式参与骨骼和牙齿的组成,25%的镁存在于软组织中 |
微量元素:
在人体中含量在0.01%以下的元素。
①一些人体必需的微量元素
| 元素名称 | 元素符号 |
| 铁 | Fe |
| 钴 | Co |
| 铜 | Cu |
| 锌 | Zn |
| 铬 | Cr |
| 锰 | Mn |
| 钼 | Mo |
| 氟 | F |
| 碘 | I |
| 硒 | Se |
②一些必需微量元素对人体的作用及14—18岁人群每天的适宜摄入量
| 元素 | 人体内的含量 | 对人体的作用 | 适宜摄入量(每天) | 摄入量过高,过低对人体健康的影响 |
| 铁 | 4—5g | 是血红蛋白的成分,能帮助氧气的运输 | 20—50mg | 缺铁会引起贫血 |
| 锌 | 2.5g | 影响人体发育 | 15.5—19mg | 缺锌会引起食欲不振,生长迟缓,发育不良 |
| 硒 | 14—21mg | 有防癌、抗癌作用 | 50μg | 缺硒可能引起表皮角质化和癌症。如摄入量过高,会使人中毒 |
| 碘 | 25—50mg | 是甲状腺激素的重要成分 | 150μg | 缺碘会引起甲状腺肿大,幼儿缺碘会影响生长发育,造成思维迟钝。过量也会引起甲状腺肿大 |
| 氟 | 2.6g | 能防治龋齿 | 1.5mg | 缺氟易产生龋齿,过量会引起氟斑牙和氟骨病 |
知识拓展:
如果人体所需的元素仅从食物中摄取还不足时,可通过食品添加剂和保健药剂来予以补充。
如在食品巾添加含钙、锌、硒、锗的化合物,或制成补钙、补锌等的保健药剂或制成加碘食盐,来增加对这些元素的摄人量。但要注意即使是人体必需的元素,也要注意适宜的摄入量,摄人量过高和过低对人体健康都有不良的影响。
定义:
化合物里各元素的质量比是原子个数与相对原子质量的乘积之比。即各元素原子的相对原子质量总和之比。计算的关键在于正确判断出各元素的原子总数。
公式:
各元素的质量比=各元素相对原子质量与相应原子个数的乘积之比。如化学式为AmBn的物质中,A、B两元素的质量比 =(A的相对原子质量×m):(B的相对原子质量×n)。
对概念公式的理解:
(1)元素是宏观概念,只讲种类,不讲个数。用元素符号表示时,7C素符号前后都不能写数字,如计算四氧化三铁(Fe3O4)中铁元素和氧元素的质量比时不能写成3Fe:4O
(2)在化学式中,原子个数比等于元素的质量除以其相对原子质量之比。如AmBn中A,B两元素的质量比为M:N,则化学式中A,B两元素的原子个数比m:n=
(3)当化学式中含有多种元素时,根据化学式可以计算出全部元素的质量比,也可以计算出其中某几种元素的质量比。
化学式中元素质量比的变式运算:
在AmBn中元素A,B的质量比等于各元素的相对原子质m与原子个数的乘积比,即A,B元素质量比= (A的相对原子质量×m):(B的相对原子质量×n),根据元素质量比的变形运算主要有:
(1)根据某化合物中元素的质最比求化学式根据化合物中元素的质量比(或元素的质量分数比)求化学式,其方法是通过元素的相对原子质量来推断化学式。通过组成元素质量比或元素的质量分数进行分式变换,转换成原子个数(比),推测化学式。
(2)根据某化合物中元素的质量比确定元素的化合价已知某化合物中元素的质量比确定某元素的化合价,可通过元素的质量比及元素的相对原子质量推断化学式中元素的原子个数之比,再根据化合物中正负化合价代数和为零的原则确定元素的化合价。
(3)根据元素的质量比确定元素的相对原子质量
化合物中元素的质量比等于相对原子质量与原子个数的乘积比,利用元素的质量比及化合物中各原子的个数即可求出元素的相对原子质量。相对原子质量之比等于元素的质量除以其原子个数所得的数值之比。
(4)物质的质量比与分子个数比之间的换算:
换算关系:物质的质量比 分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为
分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为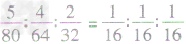 =1:1:1
=1:1:1
利用化学式变形求物质的质量比:
例:含有相同质量铁元素的Fe2O3和Fe3O4的质量比是多少?
解析:设含有相同质量铁元素的Fe2O3和Fe3O4的质量分别为x,y,为了使两者含铁元素的质量相等,可以将它们的化学式变形为铁原子数目相等的式子:
Fe2O3→Fe6O9 Fe3O4→Fe6O8
480 464
x y
x:y=480:464=30:29
答案:30:29
化合物里各元素的质量比是原子个数与相对原子质量的乘积之比。即各元素原子的相对原子质量总和之比。计算的关键在于正确判断出各元素的原子总数。
公式:
各元素的质量比=各元素相对原子质量与相应原子个数的乘积之比。如化学式为AmBn的物质中,A、B两元素的质量比 =(A的相对原子质量×m):(B的相对原子质量×n)。
对概念公式的理解:
(1)元素是宏观概念,只讲种类,不讲个数。用元素符号表示时,7C素符号前后都不能写数字,如计算四氧化三铁(Fe3O4)中铁元素和氧元素的质量比时不能写成3Fe:4O
(2)在化学式中,原子个数比等于元素的质量除以其相对原子质量之比。如AmBn中A,B两元素的质量比为M:N,则化学式中A,B两元素的原子个数比m:n=

(3)当化学式中含有多种元素时,根据化学式可以计算出全部元素的质量比,也可以计算出其中某几种元素的质量比。
化学式中元素质量比的变式运算:
在AmBn中元素A,B的质量比等于各元素的相对原子质m与原子个数的乘积比,即A,B元素质量比= (A的相对原子质量×m):(B的相对原子质量×n),根据元素质量比的变形运算主要有:
(1)根据某化合物中元素的质最比求化学式根据化合物中元素的质量比(或元素的质量分数比)求化学式,其方法是通过元素的相对原子质量来推断化学式。通过组成元素质量比或元素的质量分数进行分式变换,转换成原子个数(比),推测化学式。
(2)根据某化合物中元素的质量比确定元素的化合价已知某化合物中元素的质量比确定某元素的化合价,可通过元素的质量比及元素的相对原子质量推断化学式中元素的原子个数之比,再根据化合物中正负化合价代数和为零的原则确定元素的化合价。
(3)根据元素的质量比确定元素的相对原子质量
化合物中元素的质量比等于相对原子质量与原子个数的乘积比,利用元素的质量比及化合物中各原子的个数即可求出元素的相对原子质量。相对原子质量之比等于元素的质量除以其原子个数所得的数值之比。
(4)物质的质量比与分子个数比之间的换算:
换算关系:物质的质量比
 分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为
分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为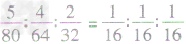 =1:1:1
=1:1:1利用化学式变形求物质的质量比:
例:含有相同质量铁元素的Fe2O3和Fe3O4的质量比是多少?
解析:设含有相同质量铁元素的Fe2O3和Fe3O4的质量分别为x,y,为了使两者含铁元素的质量相等,可以将它们的化学式变形为铁原子数目相等的式子:
Fe2O3→Fe6O9 Fe3O4→Fe6O8
480 464
x y
x:y=480:464=30:29
答案:30:29
概念:元素是具有相同核电荷数(即核内质子数)的一类原子的总称。
对元素概念的理解:
①元素是以核电荷数(即核内质子数)为标准对原子进行分类。只讲种类,不讲个数。
②质子数是划分元素种类的标准。质子数相同的原子和单核离子都属于同一种元素。如Na+与Na都属于钠元素,但Na+与NH4+不属于同一种元素。
③同种元素可以有不同的存在状态。如游离态和化合态。
④同种元素的离子因带电荷数不同,性质也不同。如Fe2+与Fe3+。
⑤同种元素的原子可以是不同种原子。如碳元素有三种不同中子数的碳原子:612C、613C、614C.
元素与原子的比较
元素、原子、分子与物质间的关系:
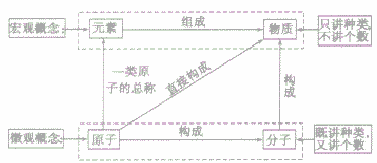
物质的组成可以从宏观和微观两个方面进行描述,其中元素是从宏观上对物质组成的描述,分子、原子是从微观上对物质构成的描述。其关系如下图;
在讨论物质的组成和结构时,应注意规范地运用这些概念,现举例如下:
(1)由分子构成的物质,有三种说法(以二氧化碳为例):
①二氧化碳是由氧元素和碳元素组成的。
②二氧化碳是由二氧化碳分子构成的。
③每个二氧化碳分子是由2个氧原子和I个碳原子构成的。
(2)由原子(或离子)直接构成的物质(如汞、食盐),有两种说法:
①汞是由汞元素组成的;食盐是由钠元素和氯元素组成的。
②汞是由汞原子构成的;食盐是由钠离子和氯离子构成的。
同位素:
同位素指具有相同的质子数,但中子数不同的同一元素的不同原子,如氢有3种同位素,分别称为氕(H)、氘(D)、氚T),即原子核内质子数均为1,但中子数分别为0,1,2的氢原子。同位素有天然存在的,也有人工合成的。同一元素的同位素虽然中子数不同,但它们的化学性质基本相同。
对元素概念的理解:
①元素是以核电荷数(即核内质子数)为标准对原子进行分类。只讲种类,不讲个数。
②质子数是划分元素种类的标准。质子数相同的原子和单核离子都属于同一种元素。如Na+与Na都属于钠元素,但Na+与NH4+不属于同一种元素。
③同种元素可以有不同的存在状态。如游离态和化合态。
④同种元素的离子因带电荷数不同,性质也不同。如Fe2+与Fe3+。
⑤同种元素的原子可以是不同种原子。如碳元素有三种不同中子数的碳原子:612C、613C、614C.
元素与原子的比较
| 元素 | 原子 | |
| 概念 | 具有相同核电荷数〔即核内质子数)的一类原子的总称 | 化学变化中的最小粒子 |
| 区分 | 只讲种类,不讲个数 | 既讲种类,又讲个数 |
| 使用范围 | 用于描述物质的宏观组成 | 用于描述物质的微观构成 |
| 举例 | 水由氢元素和氧元素组成,或说水中含有氢元素和氧元素 | 每个水分子由两个氢原子和一个氧原子构成 |
| 联系 | 元素和原子是总体和个体的关系,原子是元素的个体,是构成并体现元素性质的最小微粒;元素是一类原子的总称一种元素可以包含几种原子 | |
元素、原子、分子与物质间的关系:
物质的组成可以从宏观和微观两个方面进行描述,其中元素是从宏观上对物质组成的描述,分子、原子是从微观上对物质构成的描述。其关系如下图;

在讨论物质的组成和结构时,应注意规范地运用这些概念,现举例如下:
(1)由分子构成的物质,有三种说法(以二氧化碳为例):
①二氧化碳是由氧元素和碳元素组成的。
②二氧化碳是由二氧化碳分子构成的。
③每个二氧化碳分子是由2个氧原子和I个碳原子构成的。
(2)由原子(或离子)直接构成的物质(如汞、食盐),有两种说法:
①汞是由汞元素组成的;食盐是由钠元素和氯元素组成的。
②汞是由汞原子构成的;食盐是由钠离子和氯离子构成的。
同位素:
同位素指具有相同的质子数,但中子数不同的同一元素的不同原子,如氢有3种同位素,分别称为氕(H)、氘(D)、氚T),即原子核内质子数均为1,但中子数分别为0,1,2的氢原子。同位素有天然存在的,也有人工合成的。同一元素的同位素虽然中子数不同,但它们的化学性质基本相同。
发现相似题
与“极少数青少年有吸烟的坏习惯.香烟燃烧的烟气中有许多强致癌...”考查相似的试题有:
- 如图为某品牌牛奶的部分标签,请据此回答下列问题[第(2)~(4)题用标签中的序号填写]:(1)人体需要多种营养物质,除标签中所标...
- 下列说法不正确的是( ) A.煤是化石燃料 B.用于奥运“祥云”火炬的丙烷是一种清洁燃料 C.乙烯是高分子化合物 D.蛋白质、糖...
- 人体缺锌可能会引起的症状是[ ]A.儿童生长发育不良,智力低下B.骨质软化及骨质疏松C.甲状腺素合成减少D.贫血
- 下面是王小莉同学用连线的方式对各主题知识进行归纳的情况,其中有错误的一组是( )A. 性质与用途B. 安全常识C. 元素与人...
- 2003年5月20日,深圳发生了举国震惊的特大投毒案.犯罪分子使用的是一种名叫“毒鼠强”的剧毒鼠药(化学式为C4H8O4N4S2).下列...
- 毒品严重危害人类和社会,我们要“珍爱生命,远离毒品”.冰毒的化学式为C10H15N,有关冰毒的叙述正确的是( )A.完全燃烧只有...
- 2008年9月发生的震惊中外的食用受污染三鹿牌婴幼儿配方奶粉事件,经调查发现三鹿牌婴幼儿配方奶粉中加入了有毒的三聚氰胺,导...
- 如图11-15所示是某加碘盐包装袋上的部分图表文字(I是碘元素的符号),由此你得到的信息和作出的推测是图11-15[ ]A.此食盐是...
- 下列化合物中,含有相同原子团的是( )A.KMnO4与K2MnO4B.SO3与Na2SO3C.NH3与NH4ClD.H2SO4与MgSO4
- 下列粒子数中,能决定元素种类的是( )A.质子数B.电子数C.中子数D.最外层电子数