本试题 “下列根据反应原理设计的应用,不正确的是[ ]A.CO32-+H2OHCO3-+OH-热的纯碱溶液清洗油污B.Fe3++3H2OFe(OH)3+3H+实验室配制氯化铁溶液时加盐酸C.SnCl2+H2O==...” 主要考查您对盐水解的影响因素
双水解
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 盐水解的影响因素
- 双水解
影响盐类水解平衡的因素:
主要因素是盐本身的性质,组成的盐的酸根对应的酸越弱(或阳离子对应的碱越弱),水解程度就越大,另外还受温度、浓度及外加酸碱等因素的影响。
(1)温度:盐的水解是吸热反应,因此升高温度水解程度增大;
(2)浓度:盐的浓度越小,水解程度越大,但溶液的酸碱性一般越弱;
(3)外加酸碱:外加酸碱能促进或抑制盐的水解,使盐的水解程度降低,但由于酸(或碱)的加入,使溶液的酸(碱性)增强。
例如: 外界条件对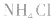 水解平衡
水解平衡
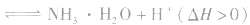 的影响
的影响
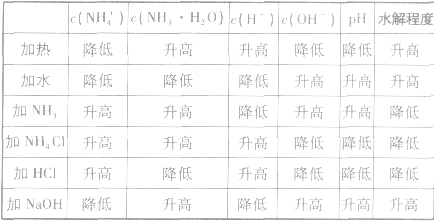
(4)能水解的阳离子与能水解的阴离子混合,会相互促进水解。常见的含下列离子的两种盐混合时,会发生较彻底的双水解反应:阳离子:Fe3+、Al3+;阴离子:CO32-、HCO3-、S2-、HS-、AlO2-、SO32-、HSO3-等。
(5)Fe3+与S2-、HS-、SO32-、HSO3-等还原性离子发生氧化还原反应,而不是发生双水解反应。
(6)HCO3-与AlO2-在溶液中也不能共存,可发生反应产生白色沉淀,但不是由于双水解反应,而是:
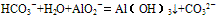
主要因素是盐本身的性质,组成的盐的酸根对应的酸越弱(或阳离子对应的碱越弱),水解程度就越大,另外还受温度、浓度及外加酸碱等因素的影响。
(1)温度:盐的水解是吸热反应,因此升高温度水解程度增大;
(2)浓度:盐的浓度越小,水解程度越大,但溶液的酸碱性一般越弱;
(3)外加酸碱:外加酸碱能促进或抑制盐的水解,使盐的水解程度降低,但由于酸(或碱)的加入,使溶液的酸(碱性)增强。
例如: 外界条件对
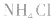 水解平衡
水解平衡
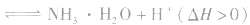 的影响
的影响
(4)能水解的阳离子与能水解的阴离子混合,会相互促进水解。常见的含下列离子的两种盐混合时,会发生较彻底的双水解反应:阳离子:Fe3+、Al3+;阴离子:CO32-、HCO3-、S2-、HS-、AlO2-、SO32-、HSO3-等。
(5)Fe3+与S2-、HS-、SO32-、HSO3-等还原性离子发生氧化还原反应,而不是发生双水解反应。
(6)HCO3-与AlO2-在溶液中也不能共存,可发生反应产生白色沉淀,但不是由于双水解反应,而是:
盐类水解程度大小比较规律:
1.盐水解生成的弱酸(或弱碱)越弱,水解程度越大。常据此判断弱酸(或弱碱)的相对强弱:如等浓度的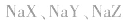 三种盐溶液,pH依次增大,则弱酸根离子
三种盐溶液,pH依次增大,则弱酸根离子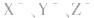 的水解程度依次增大,所以酸性HX>HY>HZ。
的水解程度依次增大,所以酸性HX>HY>HZ。
2.相同条件下:正盐>相应酸式盐。如水解程度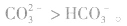
3.相互促进水解的盐>单水解的盐>相互抑制水解的盐。如水解程度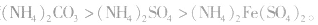
双水解:
当弱酸的酸根与弱碱的阳离子同时存在于水溶液中时,弱酸的酸根水解生成的氢氧根离子与弱碱的阳离子水解生成的氢离子反应生成水而使两种离子的水解平衡向水解方向移动而互相促进水解,而水解完全。
当弱酸的酸根与弱碱的阳离子同时存在于水溶液中时,弱酸的酸根水解生成的氢氧根离子与弱碱的阳离子水解生成的氢离子反应生成水而使两种离子的水解平衡向水解方向移动而互相促进水解,而水解完全。
发现相似题
与“下列根据反应原理设计的应用,不正确的是[ ]A.CO32-+H2OHCO3...”考查相似的试题有:
- 常温下,Na2CO3溶液中有平衡:则下列说法正确的是( )A.Na2CO3溶液中:c(Na+) > c(CO32-) > c(OH-) > c(H+)B.加入NaOH固体...
- 某溶液中FeCl3的水解反应已达平衡.FeCl3+3H2O Fe(OH)3+3HCl若要使FeCl3的水解程度增大,应采取的方法是A.加入NaHCO3B.加...
- 下列各方程式中,属于水解反应的是( )A.CO2+H2OH2CO3B.OH-+HS-S2-+H2OC.HS-+H2OH3O++S2-D.S2-+H2OHS-+OH-
- 常温下,浓度均为0.1 mol/L的4种溶液pH如下表:溶质Na2CO3NaHCO3NaClONaHSO3pH11.69.710.34.0 下列说法正确的是A.0.1 ...
- 常温下某溶液中只含有Na+、H+、OH—、A—四种离子,下列说法正确的是A.若溶质为NaA和HA,则一定存在c(A—)>c(Na+)>c(H+)>c(O...
- 请你设计实验探究促进或抑制FeCl3水解的条件,了解影响盐类水解程度的因素.仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒...
- 100mL 0.1 mol·L-1醋酸与50mL 0.2 mol·L-1氢氧化钠溶液混合,在所得溶液中A.C(Na+)>C(CH3COO-)>C(OH-)>C(H+)B.C(Na+...
- (6分)(用化学用语及必要的文字回答)(1) 配制碳酸钾溶液要加少量的__ ___,原因是____ 。 (2)FeCl3溶液蒸干并灼烧得到...
- 100mL 0.2 mol/L NH4Cl溶液,测其pH为a。加蒸馏水稀释至1L后,溶液有关变化错误的是A.c(NH4Cl)变为0.02mol/LB.水的电离程...
- 常温下,把盐酸和氨水等体积混合后,其溶液的pH恰好等于7,则下列说法中正确的是( )A.盐酸中的c(H+)一定小于氨水中的c(OH-...