本试题 “学习化学常常用到归纳的方法,下列对知识的归纳有错的一组是[ ]A.金、钢、铜--金属材料B.油锅着火、电器着火--用水浇灭C.人体缺碘--多吃海带、紫菜、海...” 主要考查您对化学元素和人体健康
灭火的原理和方法
有机化合物和无机化合物
金属材料
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学元素和人体健康
- 灭火的原理和方法
- 有机化合物和无机化合物
- 金属材料
在人体中元素的存在形式:
①碳、氢、氧、氮主要以水、糖类、蛋白质、维生素和脂肪的形式存在。
②其他的元素主要以无机盐的形式存在于水溶液中。
③钙元素主要以羟基磷酸钙[Ca10(PO4)6(OH)2] 晶体的形式存在。
常量元素:
常量元素人体中含量较多的元素有11种,它们约占人体质量的99.95%。在人体中含量超过0.01%的元素,称为常量元素。
①人体中的常量元素
| 元素名称 | 元素符号 | 质量分数% |
| 氧 | O | 65.0 |
| 碳 | C | 18.0 |
| 氢 | H | 10.0 |
| 氮 | N | 3.0 |
| 钙 | Ca | 2.0 |
| 磷 | P | 1.0 |
| 钾 | K | 0.35 |
| 硫 | S | 0.25 |
| 钠 | Na | 0.15 |
| 氯 | Cl | 0.15 |
| 镁 | Mg | 0.05 |
②一些常量元素在人体中的作用及每天适宜摄入量
| 钙 | 使骨骼和牙街具有坚硬的结构支架 | 800—1200mg | 缺钙主要影响骨骼的发育和结构,临床症状表现为青少年的佝偻病和成年人的骨质软化症及老年人的骨质疏松症。钙是无毒的元素,但摄入过量会导致高血钙,从而引起消化系统、泌尿系统等的疾病 | 海产品、豆类、奶类、各种绿叶蔬菜等 | 其中99%存在于骨骼和牙齿中,主要以羟基磷酸钙 [Ca10(PO4)6(OH)2晶体的形式存在 |
| 钠 | 细胞外液和细胞内液中的Na+和K+各自保持一定的浓度,维持人体内的水分和体液恒定的pH | 2000—2500mg | 缺钠会引起肌肉痉挛、头痛等;过量会引起水肿、高血压、贫血等 | 食盐 | 其中一半以Na+的形式存在于细胞外液中 |
| 钾 | 1850—5600mg | 缺钾会引起肌肉不发达、心律小齐等;过量会导致恶心、腹泻等 | 香蕉、柑橘、橙子、山楂、蘑菇、豆炎及其制品等 | 主要以K+的形式萍在干细胞内液中 | |
| 镁 | 促进骨骼发育、细胞遗传物质合成等 | 300—400mg | 缺镁会引起肌肉不发达、抽搐、痉挛、心律不齐等;过量会引起神经系统紊乱、肾病等 | 坚果、大豆、牛奶等 | 70%的镁以磷酸盐和碳酸盐形式参与骨骼和牙齿的组成,25%的镁存在于软组织中 |
微量元素:
在人体中含量在0.01%以下的元素。
①一些人体必需的微量元素
| 元素名称 | 元素符号 |
| 铁 | Fe |
| 钴 | Co |
| 铜 | Cu |
| 锌 | Zn |
| 铬 | Cr |
| 锰 | Mn |
| 钼 | Mo |
| 氟 | F |
| 碘 | I |
| 硒 | Se |
②一些必需微量元素对人体的作用及14—18岁人群每天的适宜摄入量
| 元素 | 人体内的含量 | 对人体的作用 | 适宜摄入量(每天) | 摄入量过高,过低对人体健康的影响 |
| 铁 | 4—5g | 是血红蛋白的成分,能帮助氧气的运输 | 20—50mg | 缺铁会引起贫血 |
| 锌 | 2.5g | 影响人体发育 | 15.5—19mg | 缺锌会引起食欲不振,生长迟缓,发育不良 |
| 硒 | 14—21mg | 有防癌、抗癌作用 | 50μg | 缺硒可能引起表皮角质化和癌症。如摄入量过高,会使人中毒 |
| 碘 | 25—50mg | 是甲状腺激素的重要成分 | 150μg | 缺碘会引起甲状腺肿大,幼儿缺碘会影响生长发育,造成思维迟钝。过量也会引起甲状腺肿大 |
| 氟 | 2.6g | 能防治龋齿 | 1.5mg | 缺氟易产生龋齿,过量会引起氟斑牙和氟骨病 |
知识拓展:
如果人体所需的元素仅从食物中摄取还不足时,可通过食品添加剂和保健药剂来予以补充。
如在食品巾添加含钙、锌、硒、锗的化合物,或制成补钙、补锌等的保健药剂或制成加碘食盐,来增加对这些元素的摄人量。但要注意即使是人体必需的元素,也要注意适宜的摄入量,摄人量过高和过低对人体健康都有不良的影响。
灭火的原理:
破坏燃烧的条件,即可达到灭火的目。
①清除可燃物或使可燃物与其他物品隔离;②隔绝氧气(或空气);③使可燃物的温度降到着火点以下。破坏燃烧的三个条件中任何一个即可达到灭火的目的。
灭火原理的实验探究:
灭火方法:
①将可燃物撤离燃烧区.与火源隔离.如液化气、煤气起火,首先要及时关闭阀门,以断绝可燃物的来源;扑灭森林火灾,可用设置隔离带的方法使森林中的树木与可燃烧区隔离
②将燃着的可燃物与空气隔离,如厨房油锅起火,盖上锅盖就能灭火;二氧化碳灭火器能火火的原因之一是灭火器喷出的大量二氧化碳在燃烧物表面形成一层二氧化碳气体层,使燃烧物与在空气隔绝,达到灭火的目的
③用大量的冷却剂(如水、干冰等)冷却可燃物,使温度降低到可燃物的着火点以下,如建筑物起火时,用高压水枪灭火等。
易错点:
灭火时降低温度不是降低着火点,着火点是物质的固有属性,一般情况下不能改变。
几种常见灭火器的灭火原理和适用范围:
泡沫灭火器的灭火原理:
1. 泡沫灭火器的灭火原理:
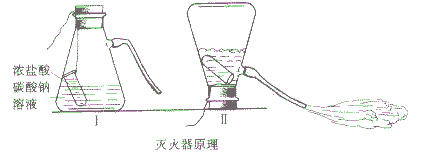
现象:当把吸滤瓶倒置后,浓HCl与Na2CO3溶液剧烈反应,产生大量CO2气体夹带着水从导管喷出。
方程式:Na2CO3+HCl==2NaCl+H2O+CO2↑(泡沫灭火原理)
2. 实际使用的泡沫灭火器,常用硫酸铝来代替盐酸(或硫酸),用碳酸氢钠来代替碳酸钠,为了产生泡沫,常放入甘草或皂角等原来制取液体。把泡沫灭火器倒转时,两种药液相互混合,发生如下反应:Al2(SO4)2+6NaHCO3==3Na2SO4+2Al(OH)3↓+6CO2↑
大量的二氧化碳跟发泡剂形成泡沫,从喷嘴中喷射出来,覆盖在燃烧物上,使燃烧物隔绝空气和降低温度,达到灭火的目的。但是,因为泡沫中含有水分,不宜用于扑救遇水发生燃烧或爆炸的物质(如钾、钠、电石等)引起的火灾;对于电器火灾,要在切断电源后才能使用泡沫灭火器。
破坏燃烧的条件,即可达到灭火的目。
①清除可燃物或使可燃物与其他物品隔离;②隔绝氧气(或空气);③使可燃物的温度降到着火点以下。破坏燃烧的三个条件中任何一个即可达到灭火的目的。
灭火原理的实验探究:
| 实验方案 | 现象 | 分析 |
点燃三支蜡烛,在其中一支蜡烛上扣一只烧杯.将另两支蜡烛放在烧杯中,然后向其中只烧杯中加适量碳酸钠和稀盐酸如下图: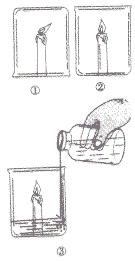 |
①在倒扣烧杯中的蜡烛熄灭 ②正放在烧杯中的蜡烛正常燃烧 ③加入适量碳酸钠和稀盐酸的烧杯中的蜡烛很快熄灭 |
①在倒扣烧杯中的蜡烛因钮气不足而熄灭 ②正放存烧杯中的蜡烛与氧气接触,温度保持在蜡烛的着火点以上,因此能正常燃烧 ⑧稀盐酸与碳酸钠迅速反应产生大量的二氧化碳气体,二氧化碳既不燃烧也不支持燃烧,所以蜡烛很快熄灭。 |
灭火方法:
①将可燃物撤离燃烧区.与火源隔离.如液化气、煤气起火,首先要及时关闭阀门,以断绝可燃物的来源;扑灭森林火灾,可用设置隔离带的方法使森林中的树木与可燃烧区隔离
②将燃着的可燃物与空气隔离,如厨房油锅起火,盖上锅盖就能灭火;二氧化碳灭火器能火火的原因之一是灭火器喷出的大量二氧化碳在燃烧物表面形成一层二氧化碳气体层,使燃烧物与在空气隔绝,达到灭火的目的
③用大量的冷却剂(如水、干冰等)冷却可燃物,使温度降低到可燃物的着火点以下,如建筑物起火时,用高压水枪灭火等。
易错点:
灭火时降低温度不是降低着火点,着火点是物质的固有属性,一般情况下不能改变。
几种常见灭火器的灭火原理和适用范围:
| 灭火器 | 灭火原理 | 适用范围 |
| 泡沫灭火器 | 灭火时.能喷射出大量二氧化碳及泡沫,它们能黏附在可燃物上,使可燃物与空气隔绝,达到灭火的目的 | 可用来扑灭木材、棉布等燃烧引起的灭火 |
| 利用压缩的二氧化碳吹出干粉(主要含有碳酸氧钠)来灭火 | 具有流动性好,喷射率高、不腐蚀容器和不易变质等优良性能,除可用来扑灭一般失火外,还可用来扑灭油、气等燃烧引起的失火 | |
| 在加压时将液态二氧化碳压缩在小钢瓶中,灭火时再将其喷出,有降温和隔绝空气的作用 | 火火时不会因留下任何痕迹而使物体损坏.因此可用来扑灭图书、档案、贵重设备、精密仪器等处的失火.使用时,手一定要先握在钢瓶的木柄上,否则.会把手冻伤。 |
泡沫灭火器的灭火原理:
1. 泡沫灭火器的灭火原理:

现象:当把吸滤瓶倒置后,浓HCl与Na2CO3溶液剧烈反应,产生大量CO2气体夹带着水从导管喷出。
方程式:Na2CO3+HCl==2NaCl+H2O+CO2↑(泡沫灭火原理)
2. 实际使用的泡沫灭火器,常用硫酸铝来代替盐酸(或硫酸),用碳酸氢钠来代替碳酸钠,为了产生泡沫,常放入甘草或皂角等原来制取液体。把泡沫灭火器倒转时,两种药液相互混合,发生如下反应:Al2(SO4)2+6NaHCO3==3Na2SO4+2Al(OH)3↓+6CO2↑
大量的二氧化碳跟发泡剂形成泡沫,从喷嘴中喷射出来,覆盖在燃烧物上,使燃烧物隔绝空气和降低温度,达到灭火的目的。但是,因为泡沫中含有水分,不宜用于扑救遇水发生燃烧或爆炸的物质(如钾、钠、电石等)引起的火灾;对于电器火灾,要在切断电源后才能使用泡沫灭火器。
有机化合物:
(1)概念:通常人们将含有碳元素的化合物称为有机化合物,简称有机物,如甲烷、乙醇、葡萄糖、淀粉等。
(2)组成和结构:有机物都含碳元素,多数含有氢元素,可能还含有氧、氮、氯、硫、磷等元素。有机物中碳原子不仅可以和H,O,Cl,,N等原子直接结合,而且碳原子之间也可以互相连接成链状或环状。原子的排列方式不同,形成有机物的结构就不同,所表现出来的性质也不同。
(3)特点:大多数有机化合物都难溶于水,易溶于有机溶剂,大多数有机化合物受热易分解,且容易燃烧,燃烧产物有CO2和水;绝大多数有机化合物不易导电、熔点低。
(4)分类:
①有机物小分子:相对分了质量较小,如乙醇,甲烷、葡萄糖等。
②有机高分子化合物:简称有机高分子,其相对分子质量比较大,从几万到几十万,甚至高达几百万或更高,如淀粉、蛋白质等。
无机化合物:
(1)概念:无机化合物简称无机物,通常指不含碳元素的化合物,但少数含碳元素的化合物,如CO,CO2, H2CO3,CaCO3等,不具有有机化合物的特点,归在无机化合物中。
(2)分类:无机化合物根据元素组成及在水中离解成的粒子特点分为氧化物、酸、碱,盐。
有机化合物与无机化合物的主要区别:
概念的理解:
像NaCl、H2SO4和NaOH等不含碳元素的化合物称为无机化合物,而少数含碳元素的化合物,如CO,CO2和CaCO3等虽然含有碳元素,但具有无机化合物的特点,也把它们看作无机化合物。有机物一定含有碳元素,但含有碳元素的化合物不一定是有机物。含有碳元素但不属于有机物的化合物主要包括: 碳的氧化物、碳酸、碳酸盐和碳酸氢盐。
(1)概念:通常人们将含有碳元素的化合物称为有机化合物,简称有机物,如甲烷、乙醇、葡萄糖、淀粉等。
(2)组成和结构:有机物都含碳元素,多数含有氢元素,可能还含有氧、氮、氯、硫、磷等元素。有机物中碳原子不仅可以和H,O,Cl,,N等原子直接结合,而且碳原子之间也可以互相连接成链状或环状。原子的排列方式不同,形成有机物的结构就不同,所表现出来的性质也不同。
(3)特点:大多数有机化合物都难溶于水,易溶于有机溶剂,大多数有机化合物受热易分解,且容易燃烧,燃烧产物有CO2和水;绝大多数有机化合物不易导电、熔点低。
(4)分类:
①有机物小分子:相对分了质量较小,如乙醇,甲烷、葡萄糖等。
②有机高分子化合物:简称有机高分子,其相对分子质量比较大,从几万到几十万,甚至高达几百万或更高,如淀粉、蛋白质等。
无机化合物:
(1)概念:无机化合物简称无机物,通常指不含碳元素的化合物,但少数含碳元素的化合物,如CO,CO2, H2CO3,CaCO3等,不具有有机化合物的特点,归在无机化合物中。
(2)分类:无机化合物根据元素组成及在水中离解成的粒子特点分为氧化物、酸、碱,盐。
氧化物,酸,碱,盐的比较:
| 物质类别 | 概念 | 分类 |
| 氧化物 | 由两种元素组成,期中一种是氧元素 | 金属氧化物:由金属元素与氧元素组成,如MgO,Fe2O3等 非金属氧化物:由非金属元素与氧元素组成,如CO2、SO2、H2O等 |
| 酸 | 能离解成氢离子和酸根离子的化合物 | 含氧酸:如H2SO4、H2CO3、HNO3等无氧酸:如HCl,H2S等 |
| 碱 | 由金属离子和氢氧根离子构成的化合物 | 可溶性碱:如NaOH,Ca(OH)2等不溶性碱:如Mg(OH)2、 Fe(OH)3等 |
| 盐 | 由金属离子(或铵根离子)和酸根离子构成的化合物 | 正盐:如NaCl、NH4Cl、Na2CO3,仅由金属离子或钱根离子和酸根离子两部分组成酸式盐:如NaHCO3、NH4HCO3,由金属离子或铵根离子、酸式酸根离子构成碱式盐;如Cu2(OH)2CO3,由金属离子、酸根离子和氢氧根离子构成 |
有机化合物与无机化合物的主要区别:
| 有机化合物 | 无机化合物 | |
| 溶解性 | 多数不溶于水。易溶于有机溶剂 | 有些溶于水而不溶于有机溶剂 |
| 耐热性 | 多数不耐热。熔点较低,一般在400℃ 以下 | 多数耐热,难熔化,熔点一般比较高 |
| 可燃性 | 多数可以燃烧 | 多数不能燃烧 |
概念的理解:
像NaCl、H2SO4和NaOH等不含碳元素的化合物称为无机化合物,而少数含碳元素的化合物,如CO,CO2和CaCO3等虽然含有碳元素,但具有无机化合物的特点,也把它们看作无机化合物。有机物一定含有碳元素,但含有碳元素的化合物不一定是有机物。含有碳元素但不属于有机物的化合物主要包括: 碳的氧化物、碳酸、碳酸盐和碳酸氢盐。
定义:
金属材料是指金属元素或以金属元素为主构成的具有金属特性的材料的统称。
常见的金属材料包括:
纯金属、合金、金属材料金属间化合物和特种金属材料等。
(注:金属氧化物(如氧化铝)不属于金属材料)
几种重要的金属:
(1)铁(Fe)
纯铁具有银白色金属光泽,质软,有良好的延展性,是电和热的良导体,密度为7.86g/cm3,属重金属,熔点为1535℃,沸点为2750℃。
(2)铝(Al)
具有银白色金属光泽,密度为2.70g/cm3,熔点为660℃,沸点为2200℃。具有良好的延展性、导电性和一导热性。在空气中,铝表面能形成一层致密的氧化物薄膜,可阻止铝进一步被氧化;铝对浓硝酸等有耐腐蚀性;在高温时还原性很强,可川来冶炼高熔点金属;导电性仅次于银和铜,常用于制造电线和电缆。
(3)铜(Cu)
具有红色金属光泽,密度为8.92g/cm3,熔点为1083℃,沸点为2595℃。具有良好的延展性、导电性和导热性。铜在干燥的空气中化学性质不活泼,在潮湿的空气中,表面可生成碱式碳酸铜(铜绿);导电性在金属中仅次于银,用于制造电线、电缆和各种电器。
(4)锌(Zn)
具有青白色金属光泽,密度为7.14g/cm3,熔点为419.4℃,沸点为907℃.锌在空气中比较稳定,在表面能形成一层致密的氧化物薄膜,所以常将锌镀在铁的表面,以防止铁被腐蚀;锌还常用于电镀、制造铜合金和干电池。
(5)钛(Ti)具有银白色金属光泽,密度为4.5g/cm3,熔点为1725℃,沸点为3260℃。具有良好的延展性和耐腐蚀性。钛和钛的合金可用于制造喷气发动机,轮船外壳,反应器和电信器材。
人类使用金属的历史:
人类最早使用的金属制品是青铜器,然后过渡到铁器时代,再后就是铝制品时代。人类使用金属的历史主要与金属的活动性及冶炼技术的难易有关。
金属之最:
(])地壳中含量最多的金属元素—铝(Al)
(2)人体中含量最高的金属元素—钙(Ca)
(3)导电、导热性最好的金属—银(Ag)
(4)熔点最高的金属—钨(W)
(5)目前世界年产址最高的金属—铁(Fe)
(6)硬度最大的金属—铬(Cr)
(7)密度最大的金属—饿(Os)
(8)密度最小的金属—铿(Li)
金属材料的分类:
金属材料可分为黑色金属材料和有色金属材料。黑色金属材料通常包括铁、铬、锰以及它们的合金,是应用最广泛的金属材料,除黑色金届外其他各种金属称为有色金属。
纯金:
在欧洲和美洲,把纯金叫做“24K","18K”金就是含黄金18份,其余的6份是铜,合为成数,就是七成五。把成数和K数互相折合,可以用下边两个公式:成数÷10×24=K数,K数÷24×10=成数。美国的金元按规定是21.6K,用上面的公式一算,可以知道应该用九成金来铸。普通的金表外壳和金笔尖都是14K,你可以算一算是几成金。
金属材料是指金属元素或以金属元素为主构成的具有金属特性的材料的统称。
常见的金属材料包括:
纯金属、合金、金属材料金属间化合物和特种金属材料等。
(注:金属氧化物(如氧化铝)不属于金属材料)
几种重要的金属:
(1)铁(Fe)
纯铁具有银白色金属光泽,质软,有良好的延展性,是电和热的良导体,密度为7.86g/cm3,属重金属,熔点为1535℃,沸点为2750℃。
(2)铝(Al)
具有银白色金属光泽,密度为2.70g/cm3,熔点为660℃,沸点为2200℃。具有良好的延展性、导电性和一导热性。在空气中,铝表面能形成一层致密的氧化物薄膜,可阻止铝进一步被氧化;铝对浓硝酸等有耐腐蚀性;在高温时还原性很强,可川来冶炼高熔点金属;导电性仅次于银和铜,常用于制造电线和电缆。
(3)铜(Cu)
具有红色金属光泽,密度为8.92g/cm3,熔点为1083℃,沸点为2595℃。具有良好的延展性、导电性和导热性。铜在干燥的空气中化学性质不活泼,在潮湿的空气中,表面可生成碱式碳酸铜(铜绿);导电性在金属中仅次于银,用于制造电线、电缆和各种电器。
(4)锌(Zn)
具有青白色金属光泽,密度为7.14g/cm3,熔点为419.4℃,沸点为907℃.锌在空气中比较稳定,在表面能形成一层致密的氧化物薄膜,所以常将锌镀在铁的表面,以防止铁被腐蚀;锌还常用于电镀、制造铜合金和干电池。
(5)钛(Ti)具有银白色金属光泽,密度为4.5g/cm3,熔点为1725℃,沸点为3260℃。具有良好的延展性和耐腐蚀性。钛和钛的合金可用于制造喷气发动机,轮船外壳,反应器和电信器材。
人类使用金属的历史:
人类最早使用的金属制品是青铜器,然后过渡到铁器时代,再后就是铝制品时代。人类使用金属的历史主要与金属的活动性及冶炼技术的难易有关。
金属之最:
(])地壳中含量最多的金属元素—铝(Al)
(2)人体中含量最高的金属元素—钙(Ca)
(3)导电、导热性最好的金属—银(Ag)
(4)熔点最高的金属—钨(W)
(5)目前世界年产址最高的金属—铁(Fe)
(6)硬度最大的金属—铬(Cr)
(7)密度最大的金属—饿(Os)
(8)密度最小的金属—铿(Li)
金属材料的分类:
金属材料可分为黑色金属材料和有色金属材料。黑色金属材料通常包括铁、铬、锰以及它们的合金,是应用最广泛的金属材料,除黑色金届外其他各种金属称为有色金属。
纯金:
在欧洲和美洲,把纯金叫做“24K","18K”金就是含黄金18份,其余的6份是铜,合为成数,就是七成五。把成数和K数互相折合,可以用下边两个公式:成数÷10×24=K数,K数÷24×10=成数。美国的金元按规定是21.6K,用上面的公式一算,可以知道应该用九成金来铸。普通的金表外壳和金笔尖都是14K,你可以算一算是几成金。
发现相似题
与“学习化学常常用到归纳的方法,下列对知识的归纳有错的一组是[...”考查相似的试题有:
- 下列说法正确的是( )A.补充微量元素越多越好B.脂肪过多会导致发胖,要尽量不吃脂肪C.用甲醛浸泡毛肚有损健康D.缺锌会引...
- 人体缺少某种元素会引起贫血,该元素是( )A.碘B.铁C.锌D.钙
- (2010山东聊城填空1)(6分)化学就在我们身边,它与的生活息息相关。从石灰石、氧气、食盐三种物质中选择与下列用途相对应...
- 下列对一些事实的解释中,不合理的是( ) 事实解释A坏血病和骨质疏松症都是因为缺钙B用扫描隧道显微镜拍摄到苯分子的图象分...
- 有些元素对人体是有害的,绝对不能摄入.下列不属于有害元素的是( )A.铅B.汞C.镉D.锰
- 下列做法存在安全隐患的是( )A.炒菜时油锅着火,立即盖上锅盖B.厨房内闻到较浓的燃气味,立即关闭阀门并开窗通风C.电器...
- 在实验室使用酒精灯时,取下酒精灯的灯帽这时酒精灯不燃烧;再用燃着的火柴去点燃,此时酒精灯燃烧起来.用燃着的火柴去点燃...
- 下列事故处理的做法错误的是( )A.煤气(CO)中毒,立即转移到通风处急救B.家用电器着火,在灭火前先切断电源C.液化石油...
- 甲醛是装修材料中常见的污染物,其分子结构如图所示,下列表述中正确的是[ ]A.甲醛是由1个碳原子、2个氢原子和1个 氧原子组...
- 下列各组物质中属于纯净物的一组是( )A.24K金、铜导线B.不锈钢、黄铜C.生铁、钢D.钱币、铜钟