本试题 “下列说法正确的是( )A.物质跟氧的反应是氧化反应,一定也是化合反应B.面粉厂车间内飞扬的面粉与空气混合,遇明火可能会发生爆炸C.钠与氯气的反应中,一...” 主要考查您对安全措施和生活经验
水的净化
化合反应
原子结构
原子的定义
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 安全措施和生活经验
- 水的净化
- 化合反应
- 原子结构
- 原子的定义
安全措施:
安全措施是为了达到保障人民生命财产安全、维护社会公共秩序稳定、防范生产安全事故发生等目的而采取的举措与行动。
生活常识:
是指人们在日常生活中总结出来的科学知识,涵盖健康、营养、饮食、居家、生活小窍门等各方面。
常见安全措施:
1、生产爆炸物的厂房不建在闹市区;
2、严禁旅客携带易燃易爆物乘车;
3、进入深洞前先做灯火试验;
4、汽车加油站、纺织厂严禁烟火;
5、屋里发生液化气泄露,应立即关闭阀门,打开门窗通风;
6、火灾自救时,用湿毛巾捂住嘴和鼻子,防止烟尘进入体内,有烟雾的地方要蹲下或匍匐前进等。
常见生活经验:
1、用生石灰作食品干燥剂;
2、金属表面涂油漆防锈;
3、燃气热水器要安装在通风的地方等。
定义:
清除水中不好的或不需要的杂质,使水达到纯净的程度。
四种净化水的方法,原理,作用:
| 净化水的方法 | 原理 | 作用 |
| 沉淀 | 食难溶性的杂质沉淀下来,并与水分层 | 使难溶性大颗粒沉降或加入明矾,形成的胶状物吸附杂质沉降 |
| 过滤 | 把液体与难溶于液体的固体物质分离 | 除去难溶性杂质 |
| 吸附 | 利用物质的吸附作用,吸附水中一些难溶性杂质,臭味和色素 | 除去难溶性杂质,部分可溶性杂质,臭味和色素 |
| 蒸馏 | 通过加热的方法使水变成水蒸气后冷凝成水 | 除去可溶性杂质,使硬水软化 |
水净化的方法:
吸附,沉淀,过滤,蒸馏,杀菌
吸附:常用明矾和活性炭,明矾溶于水后形成胶状物吸附水中的悬浮物,
活性炭不仅可以吸附水中的悬浮物,还可以吸附在水中有异味的物质和色素
沉淀:水中悬浮物别吸附后形成密度大的颗粒,从而使杂质沉淀
过滤:除去水中不溶性的杂质
蒸馏:除去可溶性杂质的方法
杀菌:常用杀毒剂:漂白粉,氯气以及新型消毒剂二氧化氯等
吸附、沉淀、过滤和蒸馏中单一操作净化程度较高的是蒸馏。综合运用时,按吸附→沉淀→过滤→蒸馏的顺序操作净化效果更好
加絮凝剂(明矾)与活性炭净水的比较:
| 净化水的方法 | 原理 | 能除去的杂质 |
| 明矾净水 | 明研溶于水后形成胶状物质,对杂质进行吸附,将微小颗粒吸附在一起形成大的固体颗粒而沉阵下来 | 不溶于水的微小固体颗粒 |
| 活性炭净水 | 利用内部疏松多孔的结构来吸附水中的微小颗粒和一些可溶于水的杂质 | 不溶于水的微小固体颗粒和部分能溶于水的杂质以及气味,颜色等 |
自来水厂净化水的过程图及步骤
1、净化过程图
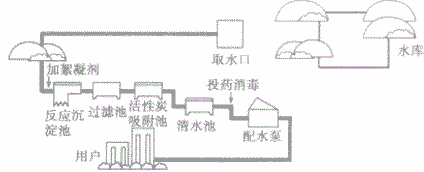
2、自来水净化步骤
①从水库中取水。
②加絮凝剂(主要是明矾),使悬浮的小颗粒状杂质被吸附凝聚。
③在反应沉淀池中沉降分离,使水澄清
④将沉淀池中流出的较澄清的水通入过滤池中,进一步除去不溶性杂质。
⑤再将水引人活性炭吸附池中,除去水中的臭味和残留的颗粒较小的不溶性杂质。
⑥细菌消毒(常用通入氯气的办法)。它是一个化学变化过程,因为除去病菌的过程.就是把病菌变成其他物质的过程。
⑦杀菌后的水就是洁净、可以饮用的自来水,通过配水泵供给用户,但水中仍然含有可以溶于水的一些杂质,所以还是混合物。
概念:指的是由两种或两种以上的物质生成一种新物质的反应。其中部分反应为氧化还原反应,部分为非氧化还原反应。 此外,化合反应一般释放出能量。
注意:不是所有的化合反应都是放热反应。
特征:多变一
表达式:a+b=ab
初中常见化合反应:
1.金属+氧气→金属氧化物
很多金属都能跟氧气直接化合。例如常见的金属铝接触空气,它的表面便能立即生成一层致密的氧化膜,可阻止内层铝继续被氧化。4Al+3O2=2Al2O3
2.非金属+氧气→非金属氧化物 经点燃,许多非金属都能在氧气里燃烧,如:C+O2 CO2
CO2
3.金属+非金属→无氧酸盐 许多金属能与非金属氯、硫等直接化合成无氧酸盐。如 2Na+Cl2 2NaCl
2NaCl
4.氢气+非金属→气态氢化物 因氢气性质比较稳定,反应一般需在点燃或加热条件下进行。如 2H2+O2 2H2O
2H2O
5.碱性氧化物+水→碱. 多数碱性氧化物不能跟水直接化合。判断某种碱性氧化物能否跟水直接化合,一般的方法是看对应碱的溶解性,对应的碱是可溶的或微溶的,则该碱性氧化物能与水直接化合。如: Na2O+H2O=2NaOH. 对应的碱是难溶的,则该碱性氧化物不能跟水直接化合。如CuO、Fe2O3都不能跟水直接化合。
6.酸性氧化物+水→含氧酸. 除SiO2外,大多数酸性氧化物能与水直接化合成含氧酸。如: CO2+H2O=H2CO3
7.碱性氧化物+酸性氧化物→含氧酸盐 Na2O+CO2=Na2CO3。大多数碱性氧化物和酸性氧化物可以进行这一反应。其碱性氧化物对应的碱碱性越强,酸性氧化物对应的酸酸性越强,反应越易进行。
8.氨+氯化氢→氯化铵 氨气易与氯化氢化合成氯化铵。如: NH3+HCl=NH4Cl
9.硫和氧气在点燃的情况下形成二氧化硫 S+O2 SO2
SO2
10.特殊化合反应
公式 A+B+…+N→X(有些化合反应属于燃烧反应)
例如:铁+氧气 四氧化三铁 3Fe+2O2
四氧化三铁 3Fe+2O2 Fe3O4
Fe3O4
注意:不是所有的化合反应都是放热反应。
特征:多变一
表达式:a+b=ab
初中常见化合反应:
1.金属+氧气→金属氧化物
很多金属都能跟氧气直接化合。例如常见的金属铝接触空气,它的表面便能立即生成一层致密的氧化膜,可阻止内层铝继续被氧化。4Al+3O2=2Al2O3
2.非金属+氧气→非金属氧化物 经点燃,许多非金属都能在氧气里燃烧,如:C+O2
 CO2
CO2 3.金属+非金属→无氧酸盐 许多金属能与非金属氯、硫等直接化合成无氧酸盐。如 2Na+Cl2
 2NaCl
2NaCl 4.氢气+非金属→气态氢化物 因氢气性质比较稳定,反应一般需在点燃或加热条件下进行。如 2H2+O2
 2H2O
2H2O 5.碱性氧化物+水→碱. 多数碱性氧化物不能跟水直接化合。判断某种碱性氧化物能否跟水直接化合,一般的方法是看对应碱的溶解性,对应的碱是可溶的或微溶的,则该碱性氧化物能与水直接化合。如: Na2O+H2O=2NaOH. 对应的碱是难溶的,则该碱性氧化物不能跟水直接化合。如CuO、Fe2O3都不能跟水直接化合。
6.酸性氧化物+水→含氧酸. 除SiO2外,大多数酸性氧化物能与水直接化合成含氧酸。如: CO2+H2O=H2CO3
7.碱性氧化物+酸性氧化物→含氧酸盐 Na2O+CO2=Na2CO3。大多数碱性氧化物和酸性氧化物可以进行这一反应。其碱性氧化物对应的碱碱性越强,酸性氧化物对应的酸酸性越强,反应越易进行。
8.氨+氯化氢→氯化铵 氨气易与氯化氢化合成氯化铵。如: NH3+HCl=NH4Cl
9.硫和氧气在点燃的情况下形成二氧化硫 S+O2
 SO2
SO210.特殊化合反应
公式 A+B+…+N→X(有些化合反应属于燃烧反应)
例如:铁+氧气
 四氧化三铁 3Fe+2O2
四氧化三铁 3Fe+2O2 Fe3O4
Fe3O4原子的构成:

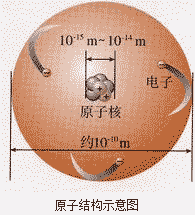
原子核的构成:

原子核相对原子来说,体积很小,但质量却很大,原子的质量主要集中在原子核上,电子的质量约为质子质量的 。
。
质子的质量为:1.6726×10-27kg
中子的质量为:1.6749×10-27kg
构成原子的粒子间的关系:

对原子构成的正确理解:
(1)原子核位于原子中心,绝大多数由质子和中构成 (有一种氢原子的原子核内只含有1个质子,无中子),体积极小,密度极大,几乎集中了原子的全部质量,核外电子质量很小,可以忽略不计。
(2)每个原子只有一个原子核,核电荷数(核内质子数)的多少,决定了原了的种类。
(3)在原子中:核电荷数二质子数二核外电子数。
(4)原子核内的质子数不一定等干中子数,如钠原子中,质子数为11,中子数为12。
(5)并不是所有的原子中都有中子,如有一种氢原子中就没有中子。
(6)在原子中,由于质子(原子核)与电子所带电荷数相等,且电性相反,因而原子中虽然存在带电的粒子,但原子在整体上不显电性。
核外电子的排布:
①电子层核外电子运动有自己的特点,在含有多个电子的原子里,有的电子通常在离核较近的区域运动,有的电子通常在离核较远的区域运动,科学家形象地将这些区域称为电子层。
②核外电子的分层排布通常用电子层来形象地表示运动着的电子离核远近的不同:离核越近,电子能量越低;离核越远,电子能量越高。电子层数、离核远近、能量高低的关系如下所示:
电子层数 1 2 3 4 5 6 7
离核远近 近→ 远
能量高低 低→ 高
③核外电子排布的规律了解一些核外电子排布的简单规律对理解原子核外电子排布的情况有很重要的作川,核外电子排布的简单规律主要有:
a.每层上的电子数最多不超过2n2(n为电子层数),如第一电子层上的电子数可能为1,也可能为2,但最多为2。
b.核外电子排布时先排第一层,排满第一层后,再排第二层,依次类推。
c.最外层上的电子数不超过8;当只有一个电子层时,最外层上的电子数不超过2。

原子的不可再分与原子的结构:
化学变化中原子不会由一种原子变成另外一种原子,即化学变化中原了的种类不变,其原因是化学变化中原子核没有发生变化。如硫燃烧生成了二氧化硫,硫和氧气中分别含有硫原子和氧原子,反应后生成的二氧化硫中仍然含硫原子和氧原子。原子不是最小粒子,只是在化学变化的范围内为“最小粒子”,它还可再分,如原子弹爆炸时的核裂变,就是原子发生了变化。原子尽管很小,但具有一定的构成,是由居于原子中心的带正电的原子核和核外带负电的电子构成的。

原子核的构成:

原子核相对原子来说,体积很小,但质量却很大,原子的质量主要集中在原子核上,电子的质量约为质子质量的
 。
。质子的质量为:1.6726×10-27kg
中子的质量为:1.6749×10-27kg
构成原子的粒子间的关系:

对原子构成的正确理解:
(1)原子核位于原子中心,绝大多数由质子和中构成 (有一种氢原子的原子核内只含有1个质子,无中子),体积极小,密度极大,几乎集中了原子的全部质量,核外电子质量很小,可以忽略不计。
(2)每个原子只有一个原子核,核电荷数(核内质子数)的多少,决定了原了的种类。
(3)在原子中:核电荷数二质子数二核外电子数。
(4)原子核内的质子数不一定等干中子数,如钠原子中,质子数为11,中子数为12。
(5)并不是所有的原子中都有中子,如有一种氢原子中就没有中子。
(6)在原子中,由于质子(原子核)与电子所带电荷数相等,且电性相反,因而原子中虽然存在带电的粒子,但原子在整体上不显电性。
核外电子的排布:
①电子层核外电子运动有自己的特点,在含有多个电子的原子里,有的电子通常在离核较近的区域运动,有的电子通常在离核较远的区域运动,科学家形象地将这些区域称为电子层。
②核外电子的分层排布通常用电子层来形象地表示运动着的电子离核远近的不同:离核越近,电子能量越低;离核越远,电子能量越高。电子层数、离核远近、能量高低的关系如下所示:
电子层数 1 2 3 4 5 6 7
离核远近 近→ 远
能量高低 低→ 高
③核外电子排布的规律了解一些核外电子排布的简单规律对理解原子核外电子排布的情况有很重要的作川,核外电子排布的简单规律主要有:
a.每层上的电子数最多不超过2n2(n为电子层数),如第一电子层上的电子数可能为1,也可能为2,但最多为2。
b.核外电子排布时先排第一层,排满第一层后,再排第二层,依次类推。
c.最外层上的电子数不超过8;当只有一个电子层时,最外层上的电子数不超过2。

原子的不可再分与原子的结构:
化学变化中原子不会由一种原子变成另外一种原子,即化学变化中原了的种类不变,其原因是化学变化中原子核没有发生变化。如硫燃烧生成了二氧化硫,硫和氧气中分别含有硫原子和氧原子,反应后生成的二氧化硫中仍然含硫原子和氧原子。原子不是最小粒子,只是在化学变化的范围内为“最小粒子”,它还可再分,如原子弹爆炸时的核裂变,就是原子发生了变化。原子尽管很小,但具有一定的构成,是由居于原子中心的带正电的原子核和核外带负电的电子构成的。
原子结构示意图:
由原子构成的物质:
绝大多数的单质是由原子构成的,如金属单质、稀有气体均是由原子直接构成的,碳、硫、磷等大多数的非金属单质也是由原子直接构成的。
原子的定义:
原子是化学变化中最小的粒子。例如,化学变化中,发生变化的是分子,原子的种类和数目都未发生变化。
对原子的概念可从以下三个方面理解:
①原子是构成物质的基本粒子之一。
②原了也可以保持物质的化学性质,如由原子直接构成的物质的化学性质就由原子保持。
③原子在化学变化中不能再分,是“化学变化中最小的粒子”,脱离化学变化这一条件,原子仍可再分。
原子的性质:
①原子的质量、体积都很小;
②原子在不停地运动;
③原子之间有一定的间隔;
④原子可以构成分子,如一个氧分子是由两个氧原子构成的;也可以直接构成物质,如稀有气体、铁、汞等都是由原子直接构成的;
⑤化学反应中原子不可再分。
原子的表示方法—元素符号:
原子可用元索符号表示:如O既可表示氧元素,也可表示1个氧原子。
分子和原子的联系与区别:
道尔顿的原子模型:
英国自然科学家约翰·道尔顿将古希腊思辨的原子论改造成定量的化学理论,提出了世界上第一个原子的理论模型。他的理论主要有以下四点:
①所有物质都是由非常微小的、不可再分的物质微粒即原子组成
②同种元素的原子的各种性质和质量都相同,不同元素的原子,主要表现为质量的不同
③原子是微小的、不可再分的实心球体
④原子是参加化学变化的最小单位,在化学反应中,原子仅仅是重新排列,而不会被创造或者消失。 虽然,经过后人证实,这是一个失败的理论模型,但道尔顿第一次将原子从哲学带入化学研究中,明确了今后化学家们努力的方向,化学真正从古老的炼金术中摆脱出来,道尔顿也因此被后人誉为“近代化学之父”。

由原子构成的物质:
绝大多数的单质是由原子构成的,如金属单质、稀有气体均是由原子直接构成的,碳、硫、磷等大多数的非金属单质也是由原子直接构成的。
原子的定义:
原子是化学变化中最小的粒子。例如,化学变化中,发生变化的是分子,原子的种类和数目都未发生变化。
对原子的概念可从以下三个方面理解:
①原子是构成物质的基本粒子之一。
②原了也可以保持物质的化学性质,如由原子直接构成的物质的化学性质就由原子保持。
③原子在化学变化中不能再分,是“化学变化中最小的粒子”,脱离化学变化这一条件,原子仍可再分。
原子的性质:
①原子的质量、体积都很小;
②原子在不停地运动;
③原子之间有一定的间隔;
④原子可以构成分子,如一个氧分子是由两个氧原子构成的;也可以直接构成物质,如稀有气体、铁、汞等都是由原子直接构成的;
⑤化学反应中原子不可再分。
原子的表示方法—元素符号:
原子可用元索符号表示:如O既可表示氧元素,也可表示1个氧原子。
分子和原子的联系与区别:
| 项目 | 分子 | 原子 | |
| 不同点 | 本质区别 | 在化学反应中可以分成原子 | 在化学反应中不能再分 |
| 构成物质情况 | 大多数物质由分子构成 | 原子也能直接构成物质,但分子是由原子构成的 | |
| 相同点 | ①质量和体积都很小 ②都在不停地运动 ③粒子间有间隔 ④都是构成物质的粒子 ⑤同种粒子性质相同,不同种粒子性质不同 | ||
| 注意事项 | ①分子是保持物质化学性质的最小粒子 ②原子是化学变化中的最小粒子 ③分子是由原子构成的 ④对于由原子直接构成的物质,原子是保持其化学性质的最小粒子 | ||
| 联系 | 分子是由原子构成的,分子,原子都是构成物质的粒子,它们的关系是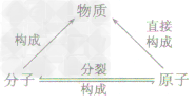 | ||
道尔顿的原子模型:
英国自然科学家约翰·道尔顿将古希腊思辨的原子论改造成定量的化学理论,提出了世界上第一个原子的理论模型。他的理论主要有以下四点:
①所有物质都是由非常微小的、不可再分的物质微粒即原子组成
②同种元素的原子的各种性质和质量都相同,不同元素的原子,主要表现为质量的不同
③原子是微小的、不可再分的实心球体
④原子是参加化学变化的最小单位,在化学反应中,原子仅仅是重新排列,而不会被创造或者消失。 虽然,经过后人证实,这是一个失败的理论模型,但道尔顿第一次将原子从哲学带入化学研究中,明确了今后化学家们努力的方向,化学真正从古老的炼金术中摆脱出来,道尔顿也因此被后人誉为“近代化学之父”。
发现相似题
与“下列说法正确的是( )A.物质跟氧的反应是氧化反应,一定也...”考查相似的试题有:
- 检验一种气体是否为二氧化碳的可靠方法是A.通入紫色石蕊试液是否会变成红色B.与等体积的空气比,看是否比空气重C.燃着的木...
- 若在高楼里发生火灾,被困人员的逃生方法正确的是A.跳楼B.乘坐电梯C.打开所有门窗D.用湿毛巾捂住口鼻,寻找安全出口,匍...
- 下面是某同学对部分化学知识的归纳,其中不正确的一组是[ ]A.化学与健康人体缺铁会引起贫血症糖类是人体能量的主要来源用活...
- 生活中处处有化学.请你用化学知识回答以下生活中的问题:(1)超市货架上的食盐品种丰富,有锌盐、钙盐、硒盐、加碘盐等等....
- 下列各项反应的化学方程式、反应现象及反应类型均正确的是[ ]化学反应 化学方程式 反应现象 反应类型A.铁在氧气中燃烧 4Fe + ...
- 下列说法正确的是( )A.由两种物质生成一种物质的反应才是化合反应B.物质和氧气发生反应的就叫氧化反应C.氧化反应一定是...
- 化石燃料属于不可再生资源,开发利用新能源就显得格外重要.(1)近几十年来大气中二氧化碳含量不断上升的主要原因是化石燃料...
- 下列说法不正确的是[ ]A.铵态氮肥一定不能与碱同时施用B.原子中质子数一定等于中子数C.pH>7的溶液一定是碱性物质D.酸溶...
- 据央视3.15特别节目《“健美猪”真相》报道,河南孟州等地养猪场采用违禁动物药品“瘦肉精”进行饲养.“瘦肉精”学名盐酸克伦特罗...
- 反应的微观模拟示意图,●表示氧原子,○表示氢原子.请你根据图示回答下列问题:(1)A、B、C三种物质中属于化合物的是______...