本试题 “小明设计了趣味实验装置(如图),其气密性良好.若要使B中尖嘴导管有“喷泉”产生,则A中加入的固体和液体可能是[ ]A.二氧化碳和石灰水B.石灰石和稀盐酸C....” 主要考查您对氧气的制取和收集
二氧化碳的制取和收集
二氧化硫的性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧气的制取和收集
- 二氧化碳的制取和收集
- 二氧化硫的性质
氧气的制取是初中化学的重点,也是历年中考的热点。我们不仅要学好氧气制取的知识,而且要触类旁通,逐步掌握实验室制取气体的一般思路和方法。中考对制取氧气的考查主要集中在药品选用、实验装置、操作步骤等方面。
实验室制取收集氧气:
| 过氧化氢制氧气 | 高锰酸钾制氧气 | |
| 药品和反应原理 | 2H2O2 2H2O+O2↑ 2H2O+O2↑ |
2KMnO4 K2MnO4 + MnO2 + O2↑ K2MnO4 + MnO2 + O2↑ |
| 发生装置 | 固液常温型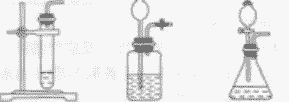 |
固体加热型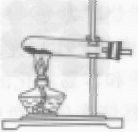 |
| 收集装置 | 氧气可用排水法收集,也可用向上排空气法收集 | |
| 整体装置图 | 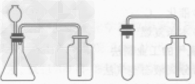 |
 |
| 操作步骤 | ①检查装置气密性 ②再锥形瓶中装入二氧化锰 ③塞好带有长颈漏斗和导管的橡皮塞(长颈漏斗的下端一定在液面以下,否则氧气会从长颈漏斗中跑出来) ④向长颈漏斗中加入过氧化氢溶液 ⑤收集氧气 |
①检查装置气密性 ②将药品平铺在试管底部,用带导管的单孔橡皮塞塞紧试管口(用高锰酸钾制取氧气,还要在管口放一小团棉花) ③将试管固定在铁架台上 ④点燃酒精灯,预热后加热试管 ⑤当导管口有连续均匀的气泡冒出时开始收集气体 ⑥收集完毕,先将导管移出水面 ⑦熄灭酒精灯。加热高锰酸钾(或氯酸钾和二氧化锰的混合物)制氧气,用排水法收集,其操作步骤可概括为:“查”“装”“定”“点”“收”“离”“熄”7个字。可用谐音记忆为“茶庄定点收利息”。 |
| 注意事项 | ①伸入试管或锥形瓶中的导管应刚刚露出橡皮塞即可,否则不利于气体的导出。 ②用排水法收集氧气时,导管应刚伸人集气瓶口即可,过长不利于水的排出,气体不易收集满。 ③用向上排空气法收集氧气时,导管要伸入集气瓶的底部,否则不利于空气的排出,收集的气体不纯。 ④用长颈漏斗时,长颈漏斗末端应在液面以下,否则氧气会从长颈漏斗中逸出。 |
①药品要平铺在试管底部,均匀受热。 ②试管口要略向下倾斜,防止药品中湿存的水分受热后变成水蒸气,遇冷凝结成水倒流回试管底部,使试管炸裂。 ③铁架台的铁夹要夹在试管的中上部(或距离试管口1/3处)。 ④试管内的导管稍伸出橡皮塞即可,这样便于气体导出。 ⑤集气瓶充满水后倒放入水槽中(瓶口要在水面下)。 ⑥加热时要先使试管均匀受热,然后酒精灯外焰要对准药品所在部位加热。 ⑦用排水法收集气体时,应注意当气泡连续均匀冒出时再收集,否则收集的气体中混有空气,当集气瓶口有大盆气泡冒出时,证明已集满。 ⑧停止加热时,应先把导管从水里撤出,再撤掉酒精灯。如果先熄灭酒精灯,试管内气体温度降低,压强减小,水槽中的水就会被倒吸入热的试管内,使试管炸裂。 ⑨用高锰酸钾制氧气时,试管口要放一小团棉花,防止加热时高锰酸钾小颗粒进人导管。 ⑩盛氧气的集气瓶应盖上玻璃片正放,因为在相同状况下氧气的密度大于空气的密度,正放可减少气体的逸散。 |
二氧化碳的制取和收集:
1.原理和药品:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
2.装置:固液混合不加热
(1)发生装置
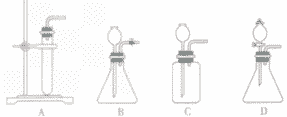
A装置为简易装置,不便于加液体;
B,C使用了长颈漏斗,便于添加液体,使用B、C装置时应注意,长颈漏斗下端管日应伸入液面以下,防止产生的气体从长颈漏斗逸出;
D装置使用了分液漏斗,便于加酸,还可以利用活塞控制反应。
(2)收集装置:二氧化碳溶于水,所以不能用排水法收集;其密度比空气大,所以可采用向上排空气法收集。
如图:
3.现象:块状固体不断溶解,产生大量气泡。
4.检验:把产生的气体通入澄清石灰水,若澄清石灰水变浑浊,证明是二氧化碳。
5.验满:将燃着的木条放在集气瓶口,如果木条的火焰熄灭,证明已集满。
6.实验步骤
a.检查装置的气密性;
b.装入石灰石(或大理石);
c. 塞紧双孔塞;
d.从长颈漏斗中加入稀盐酸;
e.收集气体;
f.验满。
7.注意事项:反应物不能用浓盐酸、硫酸、因为浓盐酸易挥发,会挥发出氯化氢气体,使制得的二氧化碳不纯;硫酸不会挥发,但会生成硫酸钙沉淀,沉淀的硫酸根附着在碳酸钙(或石灰石)表面,使碳酸钙(或石灰石)与酸的接触面积变小,最后反应停止!
实验室制取二氧化碳的选择:
实验室用大理石或石灰石(主要成分是碳酸钙)和稀盐酸制取二氧化碳。
注意:
(1)不能选用稀硫酸,因为稀硫酸与碳酸钙反应生成微溶于水的硫酸钙会橙盖在碳酸钙的表面,阻止反应继续进行。
(2)不能选用浓盐酸,因为浓盐酸易挥发,得不到纯净的二氧化碳气体。
(3)不能用碳酸钠代替石灰石,因为反应太剧烈,产生的气体难以收集。反应速率的快慢与反应物的质量分数和接触面积有关。反应物的接触面积越大,反应物的质量分数越大,反应速率就越快,反之,则越慢。
各组物质反应情况如下表所示:
| 药品 | 反应速率 |
| 块状石灰石和稀盐酸 | 产生气泡速率适中 |
| 石灰石粉末和稀盐酸 | 产生气泡速率很快 |
| 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
| 碳酸钠粉末和稀盐酸 | 产生气泡速率很快 |
概述:
二氧化硫(化学式:SO2)是最常见的硫氧化物。无色气体,有强烈刺激性气味。大气主要污染物之一。火山爆发时会喷出该气体,在许多工业过程中也会产生二氧化硫。由于煤和石油通常都含有硫化合物,因此燃烧时会生成二氧化硫。当二氧化硫溶于水中,会形成亚硫酸(酸雨的主要成分)。
物理性质:
无色,常温下为无色有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水(约为1:40)密度2.551g/L。(气体,20摄氏度下) 熔点:-72.4℃(200.75K) 沸点:-10℃(263K)
化学性质:
(1)SO2+H2O==H2SO3(亚硫酸是酸雨的主要成分)
(2)漂白性:使品红溶液褪色
二氧化硫的危险:
1. 健康危害
易被湿润的粘膜表面吸收生成亚硫酸、硫酸。对眼及呼吸道粘膜有强烈的刺激作用。大量吸入可引起肺水肿、喉水肿、声带痉挛而致窒息。
2. 急性中毒
轻度中毒时,发生流泪、畏光、咳嗽,咽、喉灼痛等;严重中毒可在数小时内发生肺水肿;极高浓度吸入可引起反射性声门痉挛而致窒息。皮肤或眼接触发生炎症或灼伤。慢性影响:长期低浓度接触,可有头痛、头昏、乏力等全身症状以及慢性鼻炎、咽喉炎、支气管炎、嗅觉及味觉减退等。少数工人有牙齿酸蚀症。
3. 环境危害
对大气可造成严重污染。容易被空气中的粉尘催化氧化,进而形成硫酸型酸雨。(化学式2SO2+2H2O+O2=2H2SO4)
4. 燃爆危险
该品不自燃,有毒,具强刺激性。
急救措施:
1. 皮肤接触 立即脱去污染的衣着,用大量流动清水冲洗;就医。
2. 眼睛接触 提起眼睑,用流动清水或生理盐水冲洗;就医。
3. 吸入 迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸;就医。
4. 食入 用水漱口,饮牛奶或生蛋清;就医。
三氧化硫:
先将硫黄或黄铁矿在空气中燃烧或焙烧,以得到二氧化硫气体。将二氧化硫氧化为三氧化硫是生产硫酸的关键,其反应为: 2SO2+O2→2SO3(可逆)
发现相似题
与“小明设计了趣味实验装置(如图),其气密性良好.若要使B中尖...”考查相似的试题有:
- 下图是实验室制取气体的一些装置,据图回答有关问题。(1)写出指定仪器的名称:① ; ② ;(2)写出一个用A装置制取氧气的化学方程...
- 请选择如图所示装置制取有关气体.(1)实验室制取CO2气体,你选用的装置是______(填字母).(2)为证明CO2能与水反应,可...
- 请根据下图所示的实验装置图填空。(1)指出图中标有数字的仪器的名称:① ,② ,③ 。(2)实验室采用装置A制取氧气时,收集装置可...
- 实验室制取气体所需装置如下图所示,请回答以下问题:(1)仪器a的名称是______.(2)用高锰酸钾制取氧气时,所选用的发生装...
- 下列叙述错误的是[ ]A.用排气法收集氧气时,应将导气管伸入集气瓶底部B.用过氧化氢制氧气,应先检查装置的气密性,再装药品...
- (22分)通过一个半月的化学学习,你已经掌握了实验室制取气体的有关规律,以下是老师提供的一些实验装置。请结合下图回答问...
- (6分)根据下图回答问题。② A B C D E(1)写出标有序号的仪器名称:① ;② 。(2)用高锰酸钾制取氧气时,所选用的发生装置...
- (6分)化学小组的同学利用下图所示的装置进行实验。回答相关问题:(1)若A中盛有石灰石,关闭K,从分液漏斗放入稀盐酸,B、...
- 谚语诗词中蕴含着科学道理。下列说法正确的是:A.“真金不怕火炼”是说黄金熔点很高B.“众人拾柴火焰高”是指可燃物越多,则着...
- 以下生活现象,属于化学变化的是 ( )A.彩纸折成纸鹤B.菜刀生锈C.保险丝熔断D.酒精挥发