本试题 “NO的生物活性已引起科学家高度重视。它与超氧离子(O2—)反应,该反应的产物本题用A为代号。在生理pH值条件下,A的半衰期为1-2秒。A被认为是人生病,如炎症、中...” 主要考查您对氮气
二氧化氮
单质磷及其化合物
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氮气
- 二氧化氮
- 单质磷及其化合物
氮元素在自然界中的存在形式:
既有游离态又有化合态。空气中含N278%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素
氮气的物理性质和化学性质:
(1)物理性质:纯净的氮气是无色气体,密度比空气略小,氮气在水中的溶解度很小,在常压下101kPa,-195.8℃氮气变成无色液体,-209.9℃变成雪花状固体。氮气的分子结构:氮分子(N2)的电子式为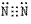 ,结构式为N≡N,由于N2分子中的N≡N键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼。
,结构式为N≡N,由于N2分子中的N≡N键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼。
(2)化学性质:氮分子化合价为0价,既可以升高也可以降低,说明氮气既有氧化性又有还原性。
①N2与H2化合生成NH3: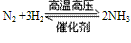
说明:该反应是一个可逆反应,是工业合成氨的原理。
②N2与金属反应(Mg Ca Sr Ba)反应: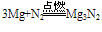
③N2与O2化合生成NO: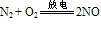
说明:在闪电或行驶的汽车引擎中会发生以上反应。
氮气的用途:
①合成氨,制硝酸;
②代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;
⑧在灯泡中填充氮气以防止钨丝被氧化或挥发;
④保存粮食、水果等食品,以防止腐烂;
⑤医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;
⑥利用液氮制造低温环境,使某些超导材料获得超导性能。
二氧化氮的物理性质和化学性质:
(1)物理性质:红棕色、有刺激性气味、有毒的气体,易溶于水、易液化,比空气重。
(2)化学性质:
与H2O反应: 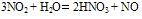
(工业制HNO3原理,在此反应中,NO2同时作氧化剂和还原剂)
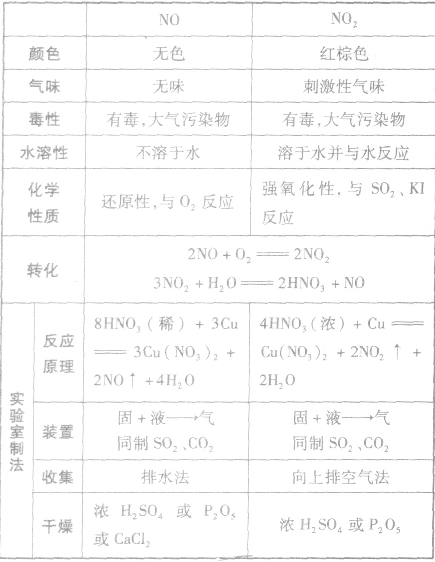
NO、NO2的性质、实验室制法的比较:
隐含反应: 的应用:
的应用:
通常“纯净”的NO2或N2O4并不纯,因为在常温、常压下能发生反应 ,由于此平衡的存在,导致一些物理量的理论值与实验值有一定的误差。例如:
,由于此平衡的存在,导致一些物理量的理论值与实验值有一定的误差。例如:
1.收集到的1mo1NO2在标准状况下的体积应小于22.4L
2.标准状况下22.4LNO2的质量大于46g。
3.NO与O2混合后,所得物质的相对分子质量应大于按体积比求得的数值。
4.温度影响“ ”平衡体系,其他条件不变,体系颜色随温度改变而改变。升高温度,气体颜色变深;降低温度,气体颜色变浅。
”平衡体系,其他条件不变,体系颜色随温度改变而改变。升高温度,气体颜色变深;降低温度,气体颜色变浅。
5.恒容时,在“ ”平衡体系中增加 N01,相当于增大压强。
”平衡体系中增加 N01,相当于增大压强。
有关混合气体NO、NO2、O2溶于水的计算:
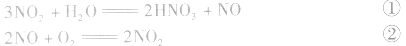
①×2+②得NO2、O2与水反应生成HN3,的化学方程式为: 
①×2+②×3得NO、O2与水反应生成HNO3的化学方程式为: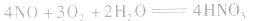
一般NO、NO2、O2与水反应,可归纳成四种情况:
1.NO和NO2混合 剩余气体为NO
剩余气体为NO
2.NO2和O2混合
3.NO和O2混合 
4.NO2、NO、O2的混合
当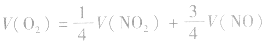 时,反应后无气体剩余
时,反应后无气体剩余
特例:当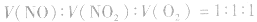 时,无气体剩余。
时,无气体剩余。
磷在自然界中的存在:
自然界中没有游离态的磷,磷主要以磷酸盐的形式存在于矿石中。磷和氮一样,是构成蛋白质的成分之一。动物的骨骼、牙齿和神经组织,植物的果实和幼芽,生物的细胞里都含有磷,磷对维持生物体正常的生理机能起着重要的作用。
磷的物理性质:
磷的单质有多种同素异形体,其中常见的是白磷和红磷。白磷和红磷的主要性质如下表。 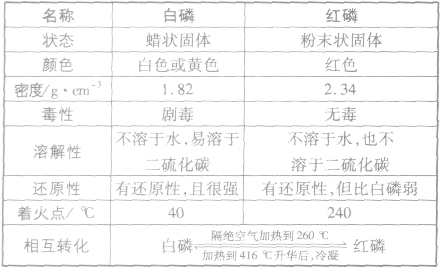
特别提醒白磷遇光会逐渐变为黄色。因此,白磷又称黄磷,白磷的颜色往往表述为“白色或黄色”。
白磷和红磷的化学性质:
白磷和红磷都能在空气或氧气中燃烧,燃烧产物一般是五氧化二磷,且反应放出大量的热,4P+5O2 2P2O5
2P2O5
磷的用途:
白磷和红磷有许多用途,如都可用于制造纯度较高的磷酸;白磷可用于制造燃烧弹、烟幕弹等;红磷可用于制农药、安全火柴等。
白磷和红磷的分子结构:
白磷的分子组成为P4,分子的空间构型为正四面体(如图A)。红磷的结构较复杂,有人认为红磷是P4分子断裂一个键后相互结合形成的长链状分子(如图B).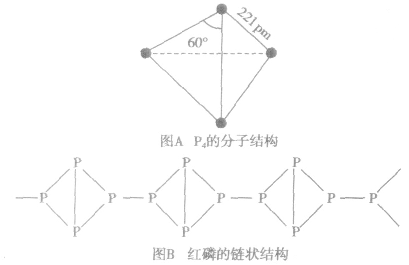
特别提醒白磷和红磷的化学式通常都写为P。
磷的化合物:
(1)五氧化二磷:
五氧化二磷的分子式为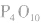 ,通常写为
,通常写为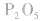 ,
,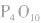 分子的空间构型如图所示。
分子的空间构型如图所示。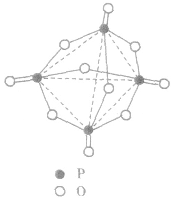
五氧化二磷通常为白色固体,由磷在空气中燃烧生成, 632K时升华。
五氧化二磷是典型的酸性氧化物,具有酸性氧化物的通性。
五氧化二磷很易跟水反应,跟冷水反应生成偏磷酸,跟热水反应生成磷酸,反应放出大量的热。 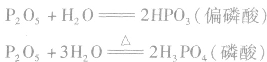
五氧化二磷的强亲水性决定了它可用作干燥剂。五氧化二磷是一种固态、酸性、无强氧化性的干燥剂,干燥能力非常强。
(2)磷酸:
磷酸为三元中强酸,属于弱电解质,易溶于水,在水中分三级电离。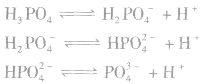
纯磷酸是无色晶体,熔点为315K.沸点较高,可溶于水。
磷酸无强氧化性,具有酸的通性。为了避免Br-、 I-被氧化,可用浓磷酸代替浓硫酸在实验室中制备HBr和HI。
(3)磷酸盐:
磷酸是三元酸,对应的盐有正盐和酸式盐: 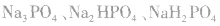 .
.
与“NO的生物活性已引起科学家高度重视。它与超氧离子(O2—)反应,...”考查相似的试题有:
- 标准状况下,将盛满NO、NO2、O2混合气体的集气瓶倒置于水中,完全溶解,无气体剩余,假如其产物不扩散,则所得溶液的物质的量...
- (2014届陕西省延安市秋高考模拟理综化学试卷)某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成...
- 氨的制法,反应方程式 ;干燥氨气用 ;用 法收集;验满的方法是 。
- 3.84 g铜和一定量浓硝酸反应,当铜反应完毕时,共收集到气体的体积为2.24 L(标准状况)。试求:(1)反应中消耗硝酸的总物质的量...
- .实验室中用Cu和稀HNO3反应制取NO,反应的方程式是: 。反应中被氧化的物质是 ,被还原的元素是 ,氧化产物是 ,还原产物是 ...
- 砒霜中毒事件时有发生,砒霜的主要成分是三氧化二砷(As2O3),医生通常给砒霜中毒患者服用一定剂量的氧化剂解毒。下列有关叙...
- 将7. 68 g铜粉与一定质量浓硝酸反应,当铜完全作用时,收集到气体4.48 L(标况下),则所消耗硝酸的物质的量是( )A.0.44 m...
- 下图表示NH4NO3和D物质为初始反应物发生的一系列变化,其中,在常温下B为液态,F为不溶于水但可溶于酸的白色固体,G与I为无色...
- 在相同条件下,分别将下列气体等体积混合于四支大小相同的试管中:①NO与NO2;②NO与O2;③NO2与O2;④SO2与NO2,将四支试管倒立...
- 图中是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。(1)在组装好装置后,若要检验A~E装置的气密性...