氧化亚铁:
(1)色态:黑色粉末
(2)溶解性:不溶于水,不与水反应,溶于盐酸、稀硫酸生成亚铁盐。
(3)稳定性:不稳定,在空气中加热时迅速被氧化成四氧化三铁
(4)氧化性:(高温下)被CO、H2、Al、C、Si等还原
(5)还原性:在空气中加热氧化为Fe3O4
氧化亚铁:
(1)色态:黑色粉末
(2)溶解性:不溶于水,不与水反应,溶于盐酸、稀硫酸生成亚铁盐。
(3)稳定性:不稳定,在空气中加热时迅速被氧化成四氧化三铁
(4)氧化性:(高温下)被CO、H2、Al、C、Si等还原
(5)还原性:在空气中加热氧化为Fe3O4
铁的氧化物:
| 化学式 |
FeO |
Fe2O3 |
Fe3O4 |
| 俗称 |
—— |
铁红 |
磁性氧化铁 |
| 色态 |
黑色粉末 |
红棕色粉末 |
黑色晶体 |
| 铁的价态 |
+2 |
+3 |
+2、+3 |
| 水溶性 |
不溶 |
不溶 |
不溶 |
| 与酸反应 |
FeO+2H+==Fe2++H2O |
Fe2O3+6H+==2Fe3++3H2O |
Fe3O4+8H+==Fe2++2Fe3++4H2O |
| 用途 |
玻璃色料 |
油漆、颜料 |
做颜料和抛光剂 |
| 氧化性 |
高温时都能与C、CO、H2反应,被还原生成Fe单质 |
氧化亚铁的化学性质:
- 铝热反应:2Al+3FeO=(高温)=Al2O3+3Fe
- 与非氧化性酸反应:FeO+2H+==Fe2++H2O
- 与氧化性酸反应:3FeO+10H++NO3-==3Fe3++NO↑+5H2O
氧化铁:
化学式Fe2O3,溶于盐酸,为红棕色粉末。其红棕色粉末为一种低级颜料,工业上称氧化铁红,用于油漆、油墨、橡胶等工业中,可做催化剂,玻璃、宝石、金属的抛光剂,可用作炼铁原料。
(1)色态:红色粉末,俗称铁锈(铁红)
(2)溶解性:溶于盐酸、稀硫酸生成+3价铁盐;难溶于水,不与水反应。
(3)氧化性:高温下被CO、H2、Al、C、Si等还原
氧化铁的化学性质:
- 铝热反应:2Al+Fe2O3=(高温)=Al2O3+2Fe
- 与强酸反应:Fe2O3+6H+==2Fe3++3H2O
- 与还原性酸(HI)反应:Fe2O3+6H++2I-==2Fe2++3H2O+I2
铁的氧化物:
| 化学式 |
FeO |
Fe2O3 |
Fe3O4 |
| 俗称 |
—— |
铁红 |
磁性氧化铁 |
| 色态 |
黑色粉末 |
红棕色粉末 |
黑色晶体 |
| 铁的价态 |
+2 |
+3 |
+2、+3 |
| 水溶性 |
不溶 |
不溶 |
不溶 |
| 与酸反应 |
FeO+2H+==Fe2++H2O |
Fe2O3+6H+==2Fe3++3H2O |
Fe3O4+8H+==Fe2++2Fe3++4H2O |
| 用途 |
玻璃色料 |
油漆、颜料 |
做颜料和抛光剂 |
| 氧化性 |
高温时都能与C、CO、H2反应,被还原生成Fe单质 |
四氧化三铁:
又称磁性氧化铁,具有磁性的黑色晶体,不溶于水,具有优良的导电性。
四氧化三铁的性质:
(1)色态:具有磁性的黑色晶体
(2)别名:磁性氧化铁、氧化铁黑、磁铁、磁石、吸铁石、偏铁酸亚铁
(3)矿物:磁铁矿
(4)溶解性:不溶于水,与酸反应生成+2、+3铁盐
(5)稳定性:稳定
(6)还原性:在高温下,易氧化成三氧化二铁。4Fe3O4+O2 6Fe2O3
6Fe2O3
(7)氧化性:在高温下可与还原剂H2、CO、Al、C等反应。



铁的氧化物:
| 化学式 |
FeO |
Fe2O3 |
Fe3O4 |
| 俗称 |
—— |
铁红 |
磁性氧化铁 |
| 色态 |
黑色粉末 |
红棕色粉末 |
黑色晶体 |
| 铁的价态 |
+2 |
+3 |
+2、+3 |
| 水溶性 |
不溶 |
不溶 |
不溶 |
| 与酸反应 |
FeO+2H+==Fe2++H2O |
Fe2O3+6H+==2Fe3++3H2O |
Fe3O4+8H+==Fe2++2Fe3++4H2O |
| 用途 |
玻璃色料 |
油漆、颜料 |
做颜料和抛光剂 |
| 氧化性 |
高温时都能与C、CO、H2反应,被还原生成Fe单质 |
氢氧化亚铁:
化学式为Fe(OH)2,白色固体,难溶于水,碱性较弱,可与常见酸反应;在空气中易被氧化,白色→灰绿色→红褐色。反应方程式如下:
(1)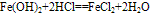
(2)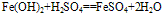
(3)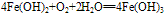
氢氧化亚铁的性质:
氢氧化亚铁极易被氧化,水中的溶解氧就可以把它氧化。
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2=△=2Fe2O3+4H2O
铁的氢氧化物:
|
Fe(OH)2 |
Fe(OH)3 |
| 色态 |
白色固体 |
红褐色固体 |
| 与盐酸反应 |
Fe(OH)2+2H+==Fe2++2H2O |
Fe(OH)3+3H+==Fe3++3H2O |
| 热稳定性 |
在空气中加热迅速生成Fe3O4 |
2Fe(OH)3=(加热)=Fe2O3+3H2O |
| 二者的关系 |
在空气中Fe(OH)2能够非常迅速地被氧化成Fe(OH)3,现象是:白色迅速变成灰绿色,最后变成红褐色。反应方程式为:4Fe(OH)2+O2+2H2O===4Fe(OH)3 |
氢氧化亚铁的制备:
因Fe(OH)2在空气中易被氧化,4Fe(OH)2+O2+2H2O===4Fe(OH)3,故Fe(OH)2在水中不能稳定存在,在实验室制取Fe(OH)2时,一定要用新制的亚铁盐和先加热驱赶掉O2的NaOH溶液,且滴管末端要插入试管内的液面以下,再滴加NaOH溶液,也可以在反应液面上滴加植物油或苯等物质进行液封,以减少Fe(OH)2与O2的接触。关于Fe(OH)2制备的方法很多,核心问题有两点,一是溶液中溶解的氧必须除去,二是反应过程必须与O2隔绝。
1、操作方法:在试管里注入少量新制备的硫酸亚铁溶液,再向其中滴入几滴煤油,用胶头滴管吸取氢氧化钠溶液,将滴管尖端插入试管里溶液液面下,逐滴滴入氢氧化钠溶液,观察现象。另外,为使氢氧化亚铁的制备成功,先将硫酸亚铁溶液加热,除去溶解的氧气。
实验现象:滴入溶液到硫酸亚铁溶液中有白色絮状沉淀生成。白色沉淀放置一段时间,振荡后迅速变成灰绿色,最后变成红褐色。
注:白色沉淀:Fe(OH)2;灰绿色沉淀:Fe(OH)2和Fe(OH)3的混合物;红褐色沉淀:Fe(OH)3
方法的改进:可在液面上滴加苯或者油进行液封,可有效防止氧的溶解。
【典例】 Ⅰ.用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需要加入________。
(2)除去蒸馏水中溶解的O2常采用________的方法。
(3)生成Fe(OH)2白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是__________________________________________________________ ________________________________________________________
Ⅱ.在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
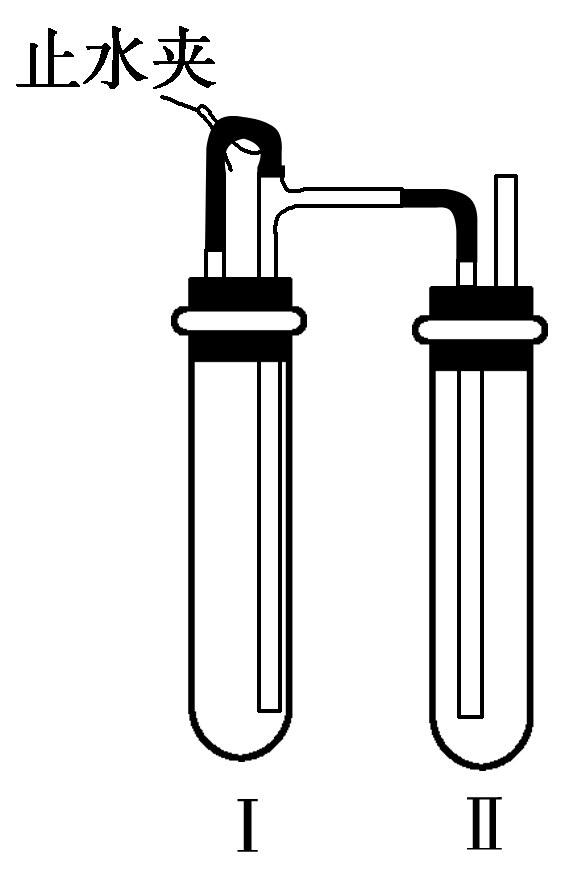
(1)在试管Ⅰ中加入的试剂是________。
(2)在试管Ⅱ中加入的试剂是________。
(3)为了制得Fe(OH)2白色沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是_____________________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,理由是_________________________________________________________________。
【答案】:Ⅰ.(1)稀H2SO4、铁屑 (2)煮沸 (3)避免生成的Fe(OH)2沉淀接触O2而被氧化 Ⅱ.(1)稀H2SO4和铁屑 (2)NaOH溶液 (3)检验试管Ⅱ出口处排出的H2的纯度,当排出的H2已经纯净时再夹紧止水夹 (4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,故外界O2不易进入
2、电化学制备
【典例】 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所法实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
①a电极材料为_______,其电极反应式为_______________。
②电解液d可以是_______,则白色沉淀在电极上生成;也可以是_______,则白色沉淀在两极之间的溶液中生成。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
③液体c为苯,其作用是______________,在加入苯之前,对d溶液进行加热处理的目的是___________。
④为了在短时间内看到白色沉淀,可以采取的措施是____________________。
A.改用稀硫酸做电解液 B.适当增大电源电压 C.适当缩小两电极间距离 D.适当降低电解液温度
⑤若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为___________。
【答案】:①Fe;Fe-2e-=Fe2+ ②C;B ③隔绝空气防止Fe(OH)2被空气氧化;排尽溶液中的氧气,防止生成的Fe(OH)2在溶液中氧化 ④B、C ⑤白色沉淀迅速变成灰绿色,最后变成红褐色
氢氧化铁:
红褐色固体,难溶于水,易与酸反应;加热可分解生成氧化铁。反应方程式如下:
(1)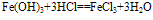
(2)
(3)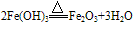
氢氧化铁胶体的制备:
操作步骤:将烧杯中的蒸馏水加热至沸腾,向沸水中滴加5~6滴饱和FeCl3溶液,继续煮沸至呈红褐色为止。
离子方程式:Fe3++3H2O=(加热)=Fe(OH)3(胶体)+3H+
铁的氢氧化物:
|
Fe(OH)2 |
Fe(OH)3 |
| 色态 |
白色固体 |
红褐色固体 |
| 与盐酸反应 |
Fe(OH)2+2H+==Fe2++2H2O |
Fe(OH)3+3H+==Fe3++3H2O |
| 热稳定性 |
在空气中加热迅速生成Fe3O4 |
2Fe(OH)3=(加热)=Fe2O3+3H2O |
| 二者的关系 |
在空气中Fe(OH)2能够非常迅速地被氧化成Fe(OH)3,现象是:白色迅速变成灰绿色,最后变成红褐色。反应方程式为:4Fe(OH)2+O2+2H2O===4Fe(OH)3 |
二氧化硫:
①化学式:SO
2②分子结构:SO
2是由极性键形成的极性分子,因此易溶于水,其晶体为分子晶体。
二氧化硫的物理性质和化学性质:
1.物理性质:
SO2是无色、有刺激性气味的有毒气体,密度比空气大,易溶于水(常温常压下,1体积水大约溶解40体积的SO2),易液化(沸点-10℃)。
2.化学性质
(1)具有酸性氧化物的通性
①将SO2通入紫色石蕊试液中,试液变红。
②能与碱性氧化物、碱及某些盐反应。如:

(2)还原性


(3)弱氧化性

(4)漂白性(不能漂白酸碱指示剂) 能和某些有色物质化合生成无色物质,生成的无色物质不稳定,易分解而恢复原色,因此,SO2的漂白并不彻底。在中学化学常见试剂中,能用SO2漂白的只有品红溶液,品红溶液 无色溶液
无色溶液 恢复原色。
恢复原色。
SO2与一些物质反应的实验现象:


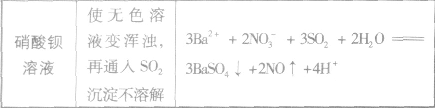
SO2与强碱反应后固体成分的确定:
SO2与强碱(如NaOH)溶液发生反应后的固体成分取决于二者的用量。遇到类似的问题,可以采用数轴分析法讨论。设SO2的物质的量为n(SO2),NaOH物质的量为n(NaOH),数轴代表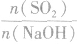 ,如下数轴所示:
,如下数轴所示:
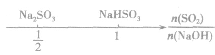
分析数轴可得:
(1)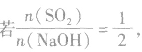 则固体物质为Na2SO3,
则固体物质为Na2SO3,
(2)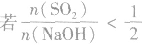 ,则固体物质为NaOH 和Na2SO3.
,则固体物质为NaOH 和Na2SO3.
(3)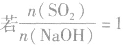 ,则同体物质为NaHSO3
,则同体物质为NaHSO3
(4)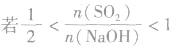 ,则固体物质为Na2SO3和NaHSO3,
,则固体物质为Na2SO3和NaHSO3,
(5)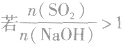 ,则固体物质为NaHSO3。
,则固体物质为NaHSO3。
二氧化硫的制备:
工业制法:

实验室制法:
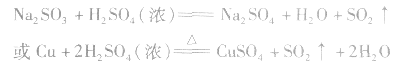
(1)收集:向上排空气法。
(2)检验:品红溶液。SO2是中学阶段学到的唯一种既能使品红褪色,加热后又能使其恢复原色的气体。
(3)尾气处理:用NaOH溶液吸收。
二氧化硫的用途:
工业上用二氧化硫漂白纸浆、毛、丝、草编制品等。此外,二氧化硫还可用于杀菌消毒,可以用作防腐剂。
二氧化硫对环境的污染及治理:
