本试题 “以下决定物质性质的因素全面、正确的是( )A.元素的化学性质:元素原子的最外层电子数B.KNO3的溶解度:温度C.分子间作用力:相对分子质量D.气体摩尔体积...” 主要考查您对阿伏加德罗定律
溶解度
原子核外电子的排布
范德华力
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 阿伏加德罗定律
- 溶解度
- 原子核外电子的排布
- 范德华力
阿伏伽德罗定律:
同温同压下,相同体积的任何气体含有相同的分子数。
阿伏伽德罗定律的使用范围:
阿伏伽德罗定律只对气体起作用,使用于任何气体,包括混合气体。
方法与技巧:
- “三同”定“一同”(温度、压强、气体体积、气体分子数);“两同”定“比例”。
- 阿伏伽德罗定律及其推论的数学表达式可由理想气体状态方程(PV=nRT)或其变形形式(PM=ρRT)推出,不用死记硬背。
理想气体状态方程:
理想气体状态方程的表达式:PV= nRT
P表示压强,V 表示体积,T表示温度,R是常数,n是气体的物质的量。
可根据此方程来推断阿伏伽德罗定律的相关推论:
| 条件 | 结论 | 语言表达 |
| T、P相同 | n1/n2=V1/V2 | 同温同压下,气体的分子数与其体积成正比 |
| T、V相同 | n1/n2=P1/P2 | 同温同体积,压强与其分子数成正比 |
| n、P相同 | V1/V2=T1/T2 | 分子数、压强相同的气体,体积与温度成正比 |
| n、T相同 | P1/P2= V2/V1 | 分子数、温度相同的气体,压强与体积成反比 |
| T、P相同 | ρ1/ρ2=M1/M2 | 同温同压下,气体的密度与相对分子质量(摩尔质量)成正比 |
| T、P、V相同 | m1/m2=M1/M2 | 同温同压下,相同体积的气体,质量与其相对分子质量成正比 |
| T、P、m相同 | M1/M2=V2/V1 | 同温同压下,等质量的气体,相对分子质量与其体积成反比 |
溶解度:
(1)固体物质的溶解度:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,单位是g,符号用S表示。
表达式: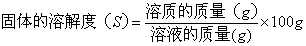
(2)气体的溶解度定义:指该气体在压强为101kPa,一定温度时,溶解在1体积水中达到饱和状态时气体的体积。
溶解度曲线:
- 溶解度曲线由于固体物质的溶解度随温度变化而变化,这种变化可以用溶解度曲线来表示。我们用纵坐标表示溶解度,横坐标表示温度,绘出固体物质的溶解度随温度变化的曲线,这种曲线叫做溶解度曲线。
- 溶解度曲线的意义:
①溶解度曲线上的点表示物质在该点所示温度下的溶解度,溶液所处的状态是饱和溶液。
②溶解度曲线下面的面积上的点,表示溶液所处的状态是不饱和状态,依其数据配制的溶液为对应湿度时的不饱和溶液。
③溶解度曲线上面的面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且该溶质有剩余。
④两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的溶解度相等。
溶解度的影响因素:
- 固体物质溶解度的影响因素:溶质,溶剂的种类,温度
- 气体物质溶解度的影响因素:溶质,溶剂的种类,温度,压强
溶解度与温度的关系:
(1)固体物质的溶解度一般随温度的升高而增大,个别物质反常,如Ca(OH)2。
(2)气体物质的溶解度,一般随温度升高而减小,随压强增大而增大。常见的可溶性气体(常温、常压时的体积数):NH3 (700),HCl(0℃时500),HBr、HI亦易溶,SO2(40),C12 (2).H2S(2.6),CO2(1)。难溶气体:H2、CO、NO。有机物中:HCHO易溶,C2H2微溶,CH4、C2H4难溶。
a.大部分固体物质的溶解度随温度的升高而增大,如KNO3、NaNO3等。
b.少数固体物质的溶解度受温度影响很小,如 NaCl。
c.极少数固体物质的溶解度随温度的升高而减小,如 Ca(OH)2
饱和溶液与不饱和溶液、过饱和溶液:
过饱和溶液:一定温度、压力下,当溶液中溶质的浓度已超过该温度、压力下溶质的溶解度,而溶质仍不析出的现象叫过饱和现象,此时的溶液称为过饱和溶液。
饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得的溶液叫做这种溶质的饱和溶液。
不饱和溶液:在一定温度下,在一定量的溶剂里,还能再溶解某种物质的溶液叫做这种溶质的不饱和溶液。
溶解度曲线:

溶解度曲线的意义:
①表示同一种物质在不同温度时的溶解度;
②表示不同物质在同一温度时的溶解度,可以比较同一温度时,不同物质的溶解度的大小。若两种物质的溶解度曲线相交,则在该温度下两种物质的溶解度相等;
③根据溶解度曲线可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法;
④根据溶解度曲线能进行有关的计算。
溶解度曲线变化规律:
1.大多数固体物质的溶解度随湿度升高而增大,曲线为"陡升型",如硝酸钾。
2.少数固体物质的溶解度受湿度的影响很小,曲线为"缓升型",如氯化钠。
3.极少数固体物质的溶解度随湿度的升高而减小,曲线为"下降型",如氢氧化钙。
4.气体物质的溶解度均随湿度的升高而减小(纵坐标表示体积),曲线也为"下降型",如氧气。
溶解度曲线的应用:
1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性。
2.比较相同湿度时(或一定湿度范围内)不同物质溶解度的大小。
3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法。
4.确定溶液的状态(饱和与不饱和)。

溶解度曲线上的点的意义:
①溶解度曲线上的点表示物质在该点所示温度下的溶解度,溶液所处的状态是饱和溶液。
②溶解度曲线下面的面积上的点,表示溶液所处的状态是不饱和状态,依其数据配制的溶液为对应湿度时的不饱和溶液。
③溶解度曲线上面的面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且该溶质有剩余。
④两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的溶解度相等。
有关溶解度的计算:
某温度下,
原子核外电子的排布:
在多电子原子中,由于各电子所具有的能量不同,因而分布在离核远近不同的区域内做高速运动。能量低的电子在离核近的区域内运动,能量高的电子在离核较远的区域内运动。
电子层:
电子层在含有多个电子的原子里,电子分别存能量不同的区域内运动。我们把不同的区域简化为不连续的壳层,也称作电子层,分别用n=1,2,3,4,5.6,7或K、L、 M、N、O、P、Q来表示从内到外的电子层 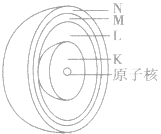

原子结构与元素的性质:
原子的核外电子排布对元素的化学性质有着非常重要的影响。元素的化学性质主要取决于原子的核外最外层电子数。
1.元素的金属性、非金属性(得失电子能力)与最外层电子数的关系
(1)稀有气体元素原子最外层电子数为8(He为 2),已达稳定结构,既不易失电子也小易得电子,所以化学性质不活泼。
(2)金属元素原子最外层电子数一般小于4,较易失去电子而达到稳定结构,其单质表现还原性。
(3)非金属元素原子最外层电子数一般大于或等于4,较易获得电子而达到稳定结构,其单质多表现氧化性。
2.元素的化合价与原子最外层电子数的关系
元素显正价还是显负价及其数值大小与原子的最外层电子数密切相关。其一般规律可归纳如下表: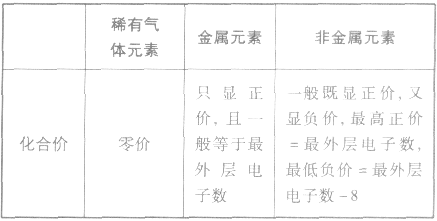
核外电子排布的一般规律:
(1)原子核外各电子层最多容纳2n2个电子.
(2)原子最外层电子数目不超过8个(K层为最外层时不超过2个)。
(3)次外层电子数目不超过18个(K层为次外层时不超过2个,L层为次外层时不超过8个)。倒数第三层电子数目不超过32个。
(4)核外电子分层排布,电子总是优先排布在能量最低的电子层里,然后由里向外,依次排布在能量逐渐升高的电子层里,即最先排K层,当K层排满后,冉排L层等。原子核外电子排布不是孤立的,而是相互联系的。层数相同而位置不同的电子层中最多容纳的电子数小一定相同,如N层为最外层时,最多只能排8个电子;N层为次外层时,最多只能排18个电子而不是32个电子(2×42=32)。
范德华力:
(1)概念:分子之间普遍存在的一种把分子聚集在一起的相互作用力。范德华力的作用能通常比化学键的键能小得多,一般只有2~20kJ/mol,主要影响物质的物理性质(熔、沸点和溶解度等)。
(2)规律:组成和结构相似的由分子构成的物质,相对分子质量越大,范德华力越大,物质的熔、沸点越高。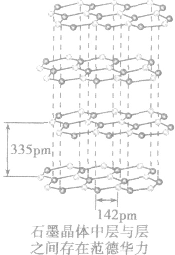
水分子间氢键的表示方法及意义:
(1)表示方法:如下图所示

(2)意义:水分子问存在氢键,使水的熔点和沸点升高,高于同主族其他元素的气态氢化物,所以常温常压下水呈液态。另外,在同态水(冰晶体)中,水分子间以氢键结合成排列规整的晶体,水分子间的氢键使冰的结构里存在较大的空隙,造成体积膨胀、密度减小至低于液态水的密度。水的这种性质对水生动物的生存有重要意义。
范德华力和氢键:
| 范德华力 | 氢键 | |
| 概念 | 把分子聚集在一起的作用力 | 分子中与氢原子形成共价键的非金属元素原子如果吸引电子的能力很强,原子半径很小,则使氢原子几乎成为“裸露”的质子,带部分正电荷,这样的分子之间氢核与带部分负电荷的非金属元素原子相互吸引,这种静电作用就是氢键 |
| 存在范围 | 分子之间 | 某些含强极性键的氢化物分子间(如 HF、H2O、NH3)等 |
| 强弱比较 | 比化学键弱得多 | 比化学键弱,但比范德华力强 |
| 影响因素 | 组成和结构相似的由分子组成的物质,相对分子质量越大,范德华力越大 | 形成氢键的除H外的非金属元素原子吸引电子的能力越强,半径越小,则氢键越强 |
| 对物质性质的影响 | 影响物质的熔沸点、溶解度等物理性质。一般来说,组成和结构相似的由分子组成的物质,随相对分子质量的增大,物质的熔沸点升高,如熔沸点: 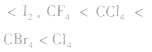 |
分子间氢键的存在,使物质的熔沸点升高,在水中的溶解度增大,如熔沸点:H2O 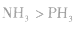 |
与“以下决定物质性质的因素全面、正确的是( )A.元素的化学性...”考查相似的试题有:
- 下列反应中不是氧化还原反应的是( )A.2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2OB.2NaHCO3Na2CO3+H2O+CO2↑C.Cl2+SO2+2H2O...
- 已知可用Co2O3代替MnO2制备Cl2,反应前后存在六种微粒:Co2O3、H2O、Cl2、H+、Cl-和Co2+.下列叙述不正确的是( )A.氧化产物...
- 下列反应中CO作还原剂的是A.2CO + O2= 2CO2B.2Fe2O3+ 3CO =" 4Fe" + 3CO2C.C + CO2= 2COD.C + H2O =" CO" + H2
- (6分)氧化还原反应的本质是 ,通常可用元素化合价的升降来判断氧化剂、还原剂。所含元素化合价升高的物质是 剂,发生反应 。
- 对于反应:2H2S+SO2="3S" +2H2O,被氧化的硫原子与被还原的硫原子的质量之比为( )A.1:1B.2:1C.3:1D.1:2
- 下列说法中正确的是[ ]A.1 mol NaCl含有6.02×1023个离子B.6.02×1023个氢气分子就是1 mol H2C.1 g H2与1 mol H2所含分子数...
- 在短周期中,由质子数为a,M层上电子数是b (a、b均大于0)的原子构成的单质X,与盐酸反应有可燃性气体生成.则下列说法中不...
- 下表为长式周期表的一部分,其中的编号代表对应的元素.试填空.(1)写出上表中元素⑨原子的外围电子排布式______.(2)元素...
- 共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是[ ]A.干冰B.氯化钠C.氢氧...
- 下列物质的变化,破坏的主要是分子间作用力的是[ ]A.碘单质的升华B.氯化钠溶于水C.将水加热变成气态D.氯化铵受热分解